可逆轉蛋白質磷酸化
得主簡介:
艾德蒙費雪
Edmond H. Fischer
資歷
1920 生於中國上海
1947 瑞士日內瓦大學化學博士
 1948-50 瑞士國家基金會研究員
1948-50 瑞士國家基金會研究員
1950-53 美國洛克斐勒基金會研究員
1953-61 西雅圖華盛頓大學生化系
助理教授及副教授
1961-90 同校教授
1990 同校榮譽教授
榮譽
1956-59 Lederle Medical Faculty Award
1963-64 Guggenheim Foundation Award
1988 Laureate of
the Senior Passano
Foundation
Award
1991 Steven C.
Beering Award
早期與柯瑞伯(Edwin G. Krebs,1918-)合力研究肝醣分解脢(Glycogen phosphorylase)並發現「CAMP蛋白激脢」(CAMP dependent protein kinase)。隨後他朝著抑制磷酸化作用方向去研究,發現有CAMP dependent protein kinase的inhibitor,進而研究磷酸化脢的水解脢(phosphorylase phosphatase)。晚年比較致力於蛋白質酪胺酸水解脢(protein tyrosine phosphatase),尤其是leucocyte common antigen CD45的化學性質以及它們在訊息傳遞的重要性。
艾德溫‧柯瑞伯
Edwin G. Krebs
資歷
1918 生於美國艾渥華藍星市
1943 美國西雅圖華盛頓大學醫學士
聖路易華盛頓大學生化系研究員
1948-52 美國西雅圖華盛頓大學生化系助理教授
1952-57 同校生化系副教授
 1957-66 同校生化系教授
1957-66 同校生化系教授
1966-68 同校醫學院助理院長
1968-76 加州大學大衛分校醫學院生化系教授兼主任
1976-83 西雅圖華盛頓大學藥理系教授兼主任
豪爾‧修基醫學研究所研究員
1983-88 同校生化、藥理系教授
1988-90 豪爾修基醫學研究所資深研究員
1991 同機構之榮譽資深研究員
榮譽
1978 Gairdner
Foundation Award
1983 George W.
Thorn Award for scientific excellence
1987 Research
Achievement Award, American
Heart
Association
1988 Passano
Foundation Award
1989 Albert Lasker
Basic Medical Research
Award Louisa
Gross Horwitz Award
1990 Steven C.
Beering Award
早期與費雪(Edmond H. Fischer,1920-)共同致力於肝醣磷酸化脢(phosphorylase)的磷酸化作用研究,發現「CAMP蛋白激脢」(CAMP dependent protein kinase)後,繼續研究細胞內其他磷酸化作用,頗有收獲。最後著力於酪胺酸水解脢(tyrosine kinase)的研究,晚期對於Ribosomal protein S6 kinase及casein kinase II的研究用心很多,尤其是關於這些kinases在細胞增殖的訊息傳遞上的功能有所發揮。
得獎研究簡介
蛋白質是生命體內最重要的成分,細胞的生長有成千成萬的蛋白質參與,舉凡細胞內的代謝途徑、生長、分化、荷爾蒙的分泌等等,都需要依賴它的相互作用及其嚴密地調節。其中最重要的調控機轉之一,就是可逆性的蛋白質磷酸化作用。每一種酵素、荷爾蒙、生長素及其他有生物活性之蛋白質都有它特有的立體構造,其功能就是依靠此種構造上的特異性來完成。蛋白質上加上一個或多個磷酸根,不但會改變它的立體形狀,並且會改變它的表面上電荷,因而就會改變它的功能或表現其他之功能。磷酸化蛋白的量與其顯現之功能呈正相關,而它的量則受制於磷酸激脢(phosphokinase)及去磷酸脢(phosphatase)的相對活性。這種蛋白質上的磷酸化及去磷酸化作用如今已成為生物代謝中主要的調控機轉。1992年諾貝爾獎頒給費雪及柯瑞伯的理由主要在表揚他們在五十年代,研究肝醣代謝脢之一的磷酸化脢(phoshorylase)時首先發現這種調控機轉。
早期他們共同研究肝醣磷酸化脢(phosphorylase)在細胞中是如何被磷酸化時發現,肝醣磷酸化脢並不是直接被CAMP磷酸化,而是經由另一種激脢(phosphorylase
kinase)來完成,隨後他們又發現這種激脢的活性也受到磷酸化的調控,並終於找到了使肝醣磷酸化脢激脢活化的激脢(phosphorylase
kinase kinasee),由於這種酵素的受質(substrate)範圍很廣,細胞內很多蛋白脢或酵素都會被它磷酸化故又稱之“CAMP dependent
protein kinase”。由於此一劃時代的發現,使得蛋白質的磷酸化及去磷酸化作用已為今日生物代謝上最重要的研究主題。
研究的起始與後續
人體每一個小小細胞中,都有成千的酵素分子在交互作用,它們是生物調控身體反應的工具,例如維持身體新陳代謝、支配生長與細胞分裂、調節荷爾蒙分泌等。然而,在所有嚴格調控的酵素反應中,最最重要的莫過於可逆轉蛋白質磷酸化反應(reversible protein phosphorylation),也就是酵素的磷酸化與去磷酸化反應。因此,率先找出並純化出這類酵素的費希爾(Edmond
H. Fischer, 1920-)與克利伯斯(Edwin G. Krebs, 1918-),便因在這個領域的奠基研究而榮獲1992年諾貝爾生理醫學獎。要討論他們的研究,必須先回溯薩瑟蘭的工作。
一九五○年代初期,美國聖路易市華盛頓大學的生物化學系,來了一位甫自歐陸戰場回國的醫生,名叫薩瑟蘭。當時薩瑟蘭選定的研究題目是:激素透過什麼樣的機制來活化肝醣分解脢(phosphorylase),以加速細胞內肝醣分解成葡萄糖,作為供應能量的來源。
薩瑟蘭首先發現當肝臟組織受到激素刺激的時候,細胞內的肝醣分解脢會被活化,當它被活化的時候,酵素身上多了許多磷酸,而活化的肝醣分解脢可經由另一個去磷酸脢(phosphatase)的作用,將它身上的磷酸去除之後而失去活性。這是第一個例子證明:細胞裡的酵素可藉由磷酸化與否,來調控酵素的活性。
薩瑟蘭接著發現,其實激素根本進不了細胞,所以也不能直接控制細胞內酵素的活性。他發現激素主要是先作用在細胞膜上,然後細胞膜就曾釋放出一些小分子到細胞內部,事實上是由這些小分子在真正調控細胞內種種酵素的活性,以完成細胞激素的反應。於是,他把激素視為體內負責細胞間通訊的「一級訊號」,而把激素刺激細胞膜,在細胞內產生的那些調控分子稱為「二級訊號」。他並且證實了體內許多不同的激素,都是利用一個叫作環狀AMP的小分子作為二級訊號。薩瑟蘭這個新構想,能解釋許多激素的作用機制,因此他在1971年也得到了諾貝爾生理醫學獎。
正當薩瑟蘭在研究環狀AMP是激素的二級訊號時,同時有兩位年輕科學家也在研究肝醣分解脢是如何被磷酸化與去磷酸化的。一個是出生中國上海但在瑞士日內瓦大學取得化學博士學位的費希爾,另一個是在美國愛荷華州出生,但在聖路易市華盛頓大學醫學院的克利伯斯。他們兩人也因為研究酵素的磷酸化與去磷酸化,在薩瑟蘭得獎後二十年,一起得到1992年諾貝爾生理醫學獎,這也是柯里教授研究室中第八位諾貝爾獎得主。
克利伯斯及費希爾二人首先研究肝醣分解脢在細胞中是怎麼被磷酸化,當他們把cAMP加入粗製的肝醣分解脢中,在有ATP及鎂離子存在時,肝醣分解脢會被磷酸化而加強其活性。但如果用非常純的肝醣分解脢,則看不出cAMP的作用。這表示cAMP並非能直接催化肝醣分解脢的磷酸化。他們於是利用各種色層分離法(chromatography),在組製的肝醣分解脢中分離出一個酵素可以催化肝醣分解脢的磷酸化反應,他們將這酵素命名作「肝醣分解脢激脢」(phosphorylase
kinase)。但是隨後,他們發現肝醣分解脢激脢本身的活性也受到磷酸化的調控。換言之,cAMP可以促使肝醣分解脢激脢的磷酸化,並提高它到肝醣分解脢磷酸化的活性。但是進一步純化的結果發現,cAMP仍然不是直接作用在肝醣分解脢激脢身上,表示在製備的過程中,有一些「雜質」混在其中,而那些「雜質」才真正是cAMP作用的目標。1968年,他們終於從兔子的肌肉中,純化出可以受cAMP刺激,而使肝醣分解脢激脢磷酸化的酵素。最初他們把它命名他肝醣分解脢激脢激脢」(phosphorylase
kinase kinase),但後來發現這酵素不只是會磷酸化肝醣分解脢激脢,它還可以受到cAMP調控而磷酸化一大堆細胞中各種蛋白及酵素,所以把這個酵素正名為「cAMp蛋白激脢」(cAMP
dependent protein kinase)。當時耶魯大學的葛林賈德(P. Greenguard)教授就作了一個大膽的預測,他說細胞中所有cAMP的作用都是透過這個cAMP蛋白激脢所完成。這個預測到今天至少在哺乳動物細胞身上還是完全正確的。
比克利伯斯晚二年,紐約愛因斯坦醫學院的羅森(0.
Rosen)教授從牛心中也分離出cAMP蛋白激脢,這種蛋白激脢與克利伯斯的激脢略有不同:它會先磷酸化自己,我們稱之為「自體磷酸化反應」(autophorsphorylation),而克利伯斯的激脢不會。所以大家就把克利伯斯的激脢稱作「第一型cAMP蛋白激脢」,而羅森的稱作「第二型cAMP蛋白激脢」。克利伯斯與費希爾隨後專注的方向也有不同;克利伯斯以研究蛋白的磷酸化激脢為主,而費希爾則改向「去磷酸化」的蛋白磷酸水解脢為主。在過去二十多年間,二人因選擇的不同而有完全不同的際遇。克利伯斯的激脢研究愈作愈順利,每天都有新的激脢被純化出來,蛋白磷酸化成了細胞調控機制的一個典範。但相反地,費希爾蛋白磷酸水解脢(phosphatase)的研究卻到處碰壁,起初這個酵素的純化就毫無進展,沒有純的蛋白質,任何研究都是枉然。隨後又發現大部分不純的磷酸水解脢不但沒有受質特異性(substrate
specificity),也不受任何激素的調控。有一度大家認為磷酸水解脢只是被動地在替激脢作善後的工作,清除激脢替蛋白加上的磷酸,讓蛋白質的活性回到基態。這種情況一直到一九八○年代中期才漸有政善。首先是費希爾的一名入室弟子柯漢(P.
Cohen),在英國把細胞中幾種主要的磷酸水解脢純化出來,並將其生化特性逐一澄清。同時,費希爾也純化出一個很特別的磷酸水解脢,專門水解酪胺酸(tyrosine
)上的磷酸,不同於其他磷酸水解脢是水解絲胺酸(serine)上的磷酸。這個脢和免疫系統及癌細胞的發生可能有密切的關連,至此費希爾才算再度活躍起來。所以蛋白質磷酸化可以視作細胞到外界訊號的一種「反應開關」。克利伯斯及費希爾以肝醣分解脢受激素二級訊號作用,而改變其活性及磷酸化程度為模式,在一九七○年代發展出一整套研究蛋白磷酸化的典範,不懂在激素的作用中,而且後來發現在神經的傳導、細胞的生長分裂,甚而在免疫系統淋巴細胞辨認外來入侵者的過程中,蛋白磷酸化都扮演重要的調控角色。目前我們幾乎可以說,所有重要的生物調節系統都多少與蛋白磷酸化有些關連。甚而有人推測在我們身體中有多於一千種不同的激脢,分別負責體內各種細胞間訊號傳遞的蛋白質磷酸化反應。研究各種激脢的特性與其負責調控的反應,並試圖了解不同激脢間的相互影響,應該是未來生物界重要的研究課題。
研究對於醫學的價值
在感染性疾病中,外來的感染因素成為抗原。這些抗原被巨噬細胞吞噬,吞噬了抗原的巨噬細胞通過一種特殊的表面蛋白與一些淋巴細胞連接,Fischer發現這種蛋白質就是磷酸激脢,它可以使一種脢去磷酸化,進而這種去磷酸化的脢激活一系列生化反應,最後這些淋巴細胞就變成炎症細胞來對抗炎症。這就是機體的免疫防衛。但是有的時候,這種防衛並不是好事,如在器官移植中,受體的免疫反應導致受體排斥移植來的肝,腎,或胰腺。環孢子菌素能有效地抑制這種反應,而它就是通過影響脢的磷酸化過程來起作用的。
|
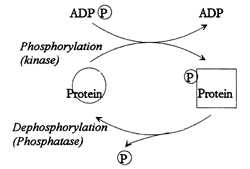
|
ADP---二磷酸腺
Protein--- 蛋白質
Phosphorylation---磷酸化作用
Kinase-----激脢
Dephosphorylation---脫磷酸作用
Phosphatase---磷酸脢
P---磷酸根
|
在一些條件下,蛋白磷酸化過程也可以導致腫瘤的發生。一個正常細胞的細胞核中存在著上百種癌基因,通常情況下,這些基因產生的蛋白質調節細胞正常的生長。一旦這些基因發生突變,它們產生的蛋白質將導致細胞的異常生長,有一些疾病就是由錯誤基因所產生的激活脢(一種蛋白質)導致的,如慢性粒細胞白血病。
可逆性蛋白磷酸化過程的發現,在生物化學研究發展史上具有特別的意義,同時對某些疾病的病因研究也有很大的價值。
參考網站:
酵素大千世界 http://140.122.143.143/NSC/bionetwork/biorelative/enzyme.html
諾貝爾獎生理學或醫學(簡)
http://chinagate.yam.com.tw/cgi-bin/g2bcgi.cgi?dest=http%3a%2f%2fwww.med8th.com%2fnobel%2fDefault.htm
http://www.medlib.ncku.edu.tw/people/1992.html
Nobel e-museum
http://www.nobel.se/