Hans Fischer ( 1881-1945 )
Fischer因為在pyrrole化學及haemin生成的研究貢獻,得到了諾貝爾化學獎。後來他繼續從事有關膽紅素和葉綠素(chlorophyll)的性質及結構方面的研究

◎ 得獎者生平
Hans Fischer - 西元1881年7月27日在德國Hoechst出生。父親為Dr. Eugen Fischer,母親為Anna Herdegen。Fisher幼時在Stuttgart接受初級教育,接著進入位於Wiesbaden的 "humanistische Gymnasium" 接受中等教育。西元1899年Fisher獲准進入大學,並同時修讀化學和醫學相關課程。他起先在University of Lausanne就讀,後來又到University of Marburg繼續求學。西元1904年,他在Marburg修得化學學士學位(under T. Zincke)﹔兩年後,他又在Munich獲得醫學執照。西元1908年,同樣是在Munich,他得到碩士學位(under F. von Müller)。
Fischer踏出社會的頭一年是在Munich的the Second Medical Clinic服務,並在the First Berlin Chemical Institute跟隨Emil Fischer(1902年諾貝爾化學獎得主)學習。1911年他回到Munich,1912年受邀擔任內科學講師。1913年Munich的the Physiological Institute (O. Frank) 聘請他擔任生理學講師。1916年,Fischer應University of Innsbruck之請,接受Medical Chemistry的教授職務。西元1918年,他轉往University of Vienna工作。
1921年4月1日之後、到他死前,他一直在Munich的Organic Chemistry at the Technische Hochschule (Technical University) 擔任教授。
Fischer 的研究重點有兩樣,一是血液、膽汁、及植物葉之中的色素組成,一是pyrrole。研究pyrrole,主要是因血液、膽汁、及植物葉之中均為自然合成的 pyrrole色素﹔此外,也特別因為pyrrole是膽紅素(bilirubin)成分。Fisher為數眾多的論文多交由Liebigs Annalen der Chemie and Hoppe-Seylers Zeitschrift für physiologische Chemie出版發表。
為了獎勵Fisher的研究成就,1925年他獲得"Geheimer Regierungsrat" (Privy Councillor) 頭銜﹔1929年他獲頒the Liebig Memorial Medal﹔1936年Harvard University 授與他榮譽博士學位﹔1937年他再得到the Davy Medal。1930年,Fischer因為在pyrrole化學及haemin生成的研究貢獻,得到了諾貝爾化學獎。西元1935年, Fischer 教授與Wiltrud Haufe女士共結連理。
Hans Fisher於西元1945年的3月31日,在Munich過世。(2)
Hans Fisher因為在pyrrole化學及haemin生成的研究貢獻而得到諾貝爾化學獎。主要的內容是有關haemin以及haemin與chlorophyll之間的關係,其重點簡述於下:(3,4)
Ø Haemin與pyrrole ring
-
Fisher已於1929年時以人工順利合成haemin,並且開始加以研究其中的porphyrins分子。Fisher並於獲頒諾貝爾獎後(1930年12月11日)的專業演講中提到有關人工合成haemin的方法。(3)
-
Fisher提出了Haemin的結構,並且詳細研究了pyrrole ring。由於pyrrole ring存在於許多自然界的重要色素分子之中,例如血紅素、葉綠素與膽紅素,故Fisher並將自然的合成pyrrole ring途徑與人工合成途徑加以比較。(3)
-
Haemin,C34H32O4N4FeCl﹔Haemin為haemoglobin的組成結構之一,haemoglobin分解後會生成蛋白質與Haemin。(3)
-
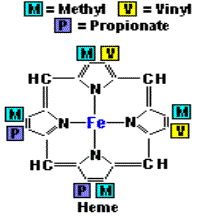
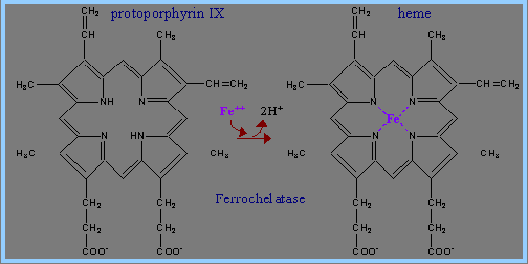
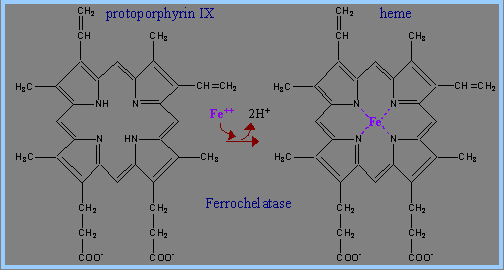
Haemin為非蛋白質,主結構為一環狀化合物,具有四個pyrrole ring﹔此環狀結構的中心為一鐵離子,而外圍的四個pyrrole ring之間以四個methenyl bridges來連結。當Haemin失去鐵離子時,四個pyrrole ring就會生成porphyrins(紫質)。(3,4)自然中的porphyrins,如圖所示,在標有1~8的氫原子部分可由各式各樣的側鍵所取代、生成各式各樣的化合物。為了方便表示出這些取代基,Fisher提出了methenyl bridges,而pyrrole ring則以方格表示,並標出八個可取代的位置。Fisher並提出了一系列的porphyrins異構物。(4)
-
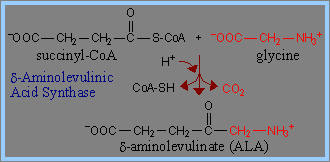
Haemin的生成(3):Haemin是由glycine以及succinyl-CoA作為precursor所共同生成。Haemin結構中的N與C原子就是來自glycine 和 acetate。
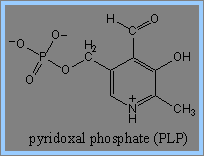
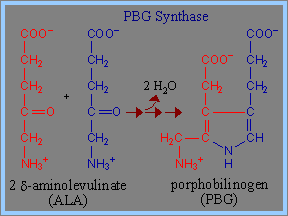
1) Haemin的生成由glycine及succinyl-CoA開始,經過decarboxylation後,生成 d-aminolevulinic acid (ALA)。在此過程中,Pyridoxal phosphate (PLP) 為transaminases、擔任coenzyme的角色,可促成ALA生成。此步驟為haemin生成步驟中的committed step,而ALA具有調節haemin生成的功能。
2) 再以兩個 d-aminolevulinate (ALA)分子組構成 porphobilinogen (PBG)當中的pyrrole ring。在這裡需要酵素PBG Synthase (Porphobilinogen Synthase),也稱為ALA Dehydratase的作用。每一個Porphobilinogen Synthase中的homo-octomeric complex 會與8個鋅離子 (Zn++) 結合。(這些可與Zn++鍵結的binding sites包括cysteine的S ligands,同樣也可與鉛離子 (Pb++) 鍵結,但與鉛離子的鍵結將會導致Porphobilinogen Synthase的活性受抑制。)然後,四個porphyrin ring 可組成一個porphobilinogen (PBG)。

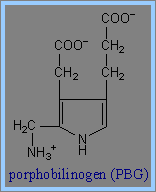
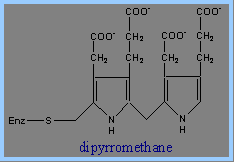
3) 接下來需要Porphobilinogen Deaminase的反應。Porphobilinogen Deaminase具有dipyrromethane prosythetic group。 Porphobilinogen Deaminase可由兩個PBG代謝生成 dipyrromethane prosthetic group。因此先由6個PBG分子形成hexapyrrole結構,再水解出一個dipyrromethane,然後生成free hydroxymethylbilane。
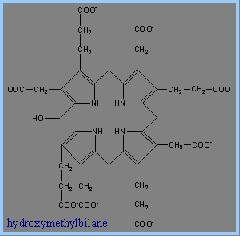
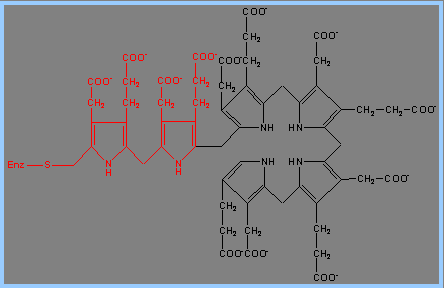
4) 接著Uroporphyrinogen III Synthase會將linear form tetrapyrrole hydroxymethylbilane 轉為macrocyclic uroporphyrinogen III。Uroporphyrinogen III Synthase 可使linear form閉合成環狀,並形成對稱結構的tetrapyrrole。這個重組結構的產物被稱為spiro intermediate。
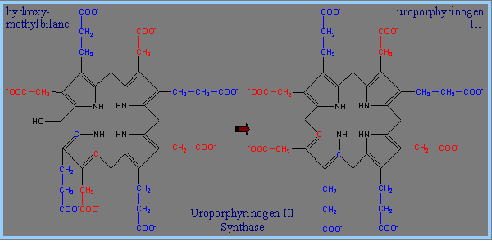
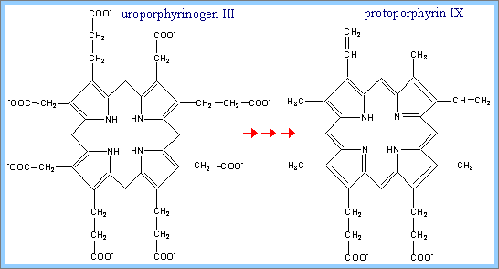
5) 將uroporphyrinogen III轉為 protoporphyrin IX:
(A)將四個acetyl side chains作decarboxylation,形成methyl groups。
(B)將其中兩個propionyl side chains作oxidative decarboxylation,形成vinyl groups。
(C)氧化生成更多的雙鍵結構,然後以Protoporphyrinogen Oxidase作用。
(D) 生成protoporphyrin IX。
6) 鐵離子Fe2+與protoporphyrin IX作用,生成Ferrocheletase,以形成haemin (heme)。
7) Haemin的生成反應式總表(4):

Fisher發現葉綠素中同樣也具有haemin結構,但其中心為Mg++,而非鐵離子。他並且繼續研究葉綠素的結構。他並且研究膽酸分解成 porphins的過程,而在1944年成功的以人工合成膽紅素。(2)
葉綠素是參與光合作用的主要色素,它存在植物細胞內的葉綠體中.葉綠素反射綠光並吸收紅光和藍光,使植物呈現綠色。葉綠素有若干形式,其中最重要的一種是葉綠素a。它存在於植物、綠藻和藍綠菌中。葉綠素是所有生物最終依賴一種能特殊接受光激作用的化學物質。
葉綠素常與類囊體膜上的蛋白質結合而存在,是一種色素蛋白複合體。綠葉中的葉綠素含量約占鮮重量的0.05~0.20%,乾重的5%左右。葉綠素含量的變異甚大。葉綠素的基本單位是普菲林環(porphyrin ring),是由4個比咯環(pyrrole)連成一個大環,而環中央是鎂(Mg)原子,比咯環具有特殊的側鍵,其中之一為長鍵醇,稱謂葉醇(Phytol)。葉綠素a與葉綠素b在構造上稍異,前者在側鍵(II的3C位置)上是-CH3-,但後者則為-CH0-。葉綠素在有機溶媒中,顯示普菲林化合物獨特的光吸收特性。葉綠素主要是吸收紅光與藍光。於乙醚溶劑中,葉綠素a的兩處吸收高峰位置是430nm和660nm,葉綠素b在435nm及643nm。(19)
◎ 現今之相關研究發展
Ø 自然界中,紫質 (haemin) 化合物常具有非常重要的生理功能。例如血紅素中的血質即為鐵紫質,而植物光合作用的色素即為鎂紫質。以下為較重要之紫質化合物:(1)
-
血紅素:haemoglobin,鐵紫質與血紅蛋白 (globin) 結合形成,此複合蛋白具有和氧形成可逆 結合的能力,在血液中擔任氧氣輸送的機制。
-
無脊椎血紅蛋白:erythroruorins,存在於一些無脊椎動物之血液及組織液中的鐵紫質蛋白。功能與血紅素相似。
-
肌血紅素:myoglobin,為脊椎動物與無脊椎動物肌肉蛋白中的呼吸蛋白。肌血紅素的結構與血紅素結構中的其中一種subunit相似。
-
細胞色素:cytochromes,在生物氧化還原反應的電子傳遞鏈中具有重要功能。例如,cytochrome C。
-
過氫氧脢:catalases,為鐵紫質酵素,其中數種已人工結晶成功。在植物中,過氫氧脢的活性極低,而是由另 6.色胺酸比各脢:tryptophan pyrrolase,為一種鐵紫質蛋白,可催化色胺酸氧化成甲醯犬尿胺酸 (fprmyl kynurenine)。在人體,若此種紫質蛋白代謝有障礙,即很有可能引發此種嚴重疾病一種鐵紫質酵素,過氧化氫脢 (peroxidases) 來執行類似功能。
Ø 紫質具有顏色和螢光:
-
紫質是有色的。科學界在研究紫質及其衍生物時,發現每一種紫質均會 呈現特有的吸收光譜,不論是在可見光或是紫外光範圍,其值都相當大。這就是 porphin ring的一個特徵,不論其側鍵之性質為何,均有此特徵。(1)
-
紫質在人體排遺物之中的存在有其臨床意義。當紫質代謝有問題時,便會造成紫質沉著症 (porphyrias),此時糞便及尿液中的紫質含量便會增加。故可藉由分離糞紫質及尿紫質來作光譜分析定量。另外,也可以測定ALA和PBG的含量來檢測是否患有紫質沉著症 (porphyrias)。
-
紫質沉著症 (porphyrias):當調節血質合成酵素之基因發生突變,就會造成先天性代謝失調症狀。此病不常發生,症狀為畏光 (喜好夜間活動)、及紫質沉著所引起的肢體嚴重變形。有人推測傳說中的狼人即可能患有此病症。紫質不正常累積發病,臨床症狀包括皮膚異常敏感、傷口不易癒合,陽光會引起皮膚損傷而潰爛、結疤、皮膚色素沉著;有些病人則會腹部絞痛、心跳過快、惡心嘔吐及焦慮不安。(1)
-
另外,現在更有學者利用紫質衍生物治療肺癌。有一種感光物質叫HpD(Hematoporphrine Derivative)-血紫質衍生物-注入體內後會分佈到體內各細胞內 ,包括癌細胞 。 它在癌細胞停留的時間較正常的細胞為長 ,且濃度高達十倍左右 ,因此在注射48-72小時後 ,正常細胞內的血紫質衍生物已大部份被排出體外 ,而癌細胞內尚存有此程HpD 。如果此時我們從體外給予一種波長620-630nm的紅色光即可剌激此在癌軸胞內的HpD,成為帶有高能量的激動狀態的HpD,此種激動狀態的HpD會使癌細胞內氧分子,變成為單價氧離子,此種氧離子對癌細胞是有毒的,可使它破壞而死亡。目前要發出 620-630nm波長的紅色光的光源,大部份都使用鐳射來發出。在1980年代初期,先進國家採用Argon-Dye(氯-色素)雷射所發出的紅色光,但是此種雷射光對癌組織的穿透力不甚理想。最近二年來,世界較大的醫學中心開始採用Gold Vapor(金蒸氣)雷射所發出的雷射光。此種雷射光對癌組織的穿透力要較前者為強。(5)
-
利用其他不同的紫質衍生物,同樣也可治療其他種類癌症。例如膀胱癌。這一類的治療方式均稱為「光力治療」。但缺點是缺點是造成正常組織傷害受損、且病人須在暗室六週之久,以免引起光 傷害,目前亦未廣泛接受。
Reference
-
Murray著, 翁鵬杰等編譯, 哈伯氏生物化學, 22版, 1993年, p.411-128, 液宣出版社
-
http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb2/part1/heme.htm
-
http://www.nobel.se/chemistry/laureates/1930/fischer-bio.html
-
http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb2/part1/heme.htm
-
http://bioresearch.ac.uk/browse/mesh/detail/C0018966L0018966.htm
-
http://www.biochem.mcw.edu/~herman/science_ed/Pages/hemoglobin/real1.html#Part3
-
http://content.edu.tw/junior/bio/tc_wc/textbook/ch03/supply3-06.htm
本網頁內容由 生科系 梁馨芸同學提供