NMR 基礎原理介紹II
整理: 黃詩宜
核磁共振(nuclear magnetic resonance),核是指原子核,磁是指磁場,主要是指有磁矩的原子核在靜磁場中,受電磁波的影響而產生的共振躍遷現象。
1945 年 12 月,美國哈佛大學 E.M. Purcell 等人,首先觀察到石蠟樣品中質子(即氫原子核)的核磁共振吸收信號;1946 年 1 月,美國史丹福大學 F. Bloch 研究小組在水樣品中也觀察到質子的核磁共振信號。Bloch 和 Purcell 兩人由於這項成就,獲得了 1952 年諾貝爾物理獎。(12)
核磁共振被證實之後,無數科學家加入研究的行列,使得此項技術迅速成為在物理、化學、生物、地質、醫學等領域研究之利器,尤其是應用在醫學診斷上的 核磁共振顯像(magnetic resonance imaging,MRI),也就是俗稱的核磁共振斷層掃描,更是自X光發現以來,醫學診斷技術的重大進展。(1)
2.基本原理
1924年物理學家鮑利(Wolfgang Pauli)提出:物質中的原子核,在某些狀況下,會以角動量運動,即自旋的方式,而變得有磁性(1)。核磁共振光譜法是在探討物質與電磁波的作用時所分支出的一門學問。將分子置入強大的外磁場中,核磁距與外加磁場相互作用,就會吸收(absorption)無線電波,這現象於1945年被F. Block與E. Purcell發現,並於1952年共同獲得諾貝爾獎(14)。這種電磁波被吸收的現象主要來自於原子核能階的躍升,如Fig.1所示,即從低能階自旋翻轉(spin-flips)至較高能態,但處於高能階時較不穩定,會以光或能量的釋放回復至原來的狀態(即relaxation)(3)。由於核磁共振的性質會隨核子種類、外加電場大小,或外圍電子雲及磁力線的總和而變化,因此針對同一種原子而言,其所吸收的無線電波頻率,便會隨原子本身在分子中所處環境的不同而變化,測量這種變化可加以推斷該原子於分子中所處的位置,及相鄰同種類原子間的距離,進而了解整個分子的結構。核磁共振波譜儀就是利用這種原理而設計,它具有一偵測器可測得電磁波的吸收,所造成的線路阻抗改變引發的電子訊號,經由分析器將訊號的強度對頻率作圖,而得到核磁共振波譜圖。(4)
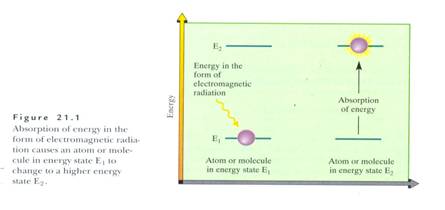
Fig.1 能量的吸收-當加入適當頻率的電磁波時(即電磁波之頻率等於兩能階之差異),會發生能量吸收(absorption)的現象:電磁輻射射入低能階(E1)的原子或分子時,原子或分子會吸收能量而躍升至高能階(E2)(摘自William H. Brown,Introduction to Organic Chemistry)
首先,簡述一下電磁輻射*a之原理。電磁輻射原理中最重要的兩個因素為wavelength*b(波長)和frequency*c(頻率),通常分別用λ和υ,其單位為meter(公尺)和hertz(Hz,赫茲)*d,下列有一公式說明它們之間的關係:
λυ=
C C:光速,3.00×108
m/s
此外探討一莫耳光子(photon)的能量時也和波長及頻率有關,公式如下:
E=hυ= h‧C / λ
其中E為能量,單位是kcal
/ mol;h為Planck’s
常數,為9.54
×10-14
kcal‧s‧mol-1,根據上列公式而求出連續光譜之頻率、波長及能量,如Fig.2。(5)
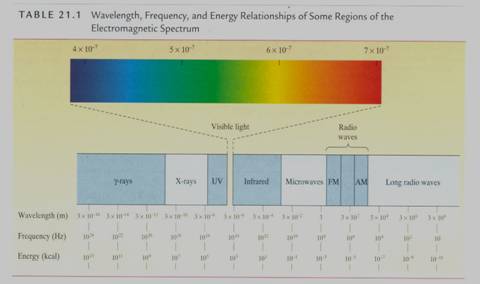
Fig.2 連續光譜之頻率、波長及能量(摘自William H. Brown,Introduction to Organic Chemistry)
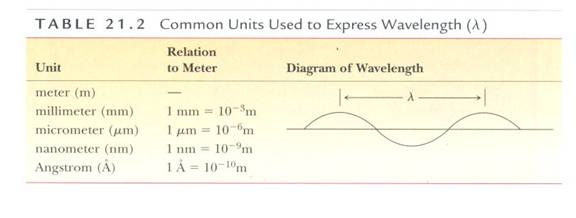
Fig.3 波長之共同單位(摘自William H. Brown,Introduction to Organic Chemistry)
再者,說明核在磁場的旋轉方向及其能量之關係:核的自旋位向在外磁場的影響下可使自己的小磁場和外磁場同向(平行)或反向(反平行)排列。這兩種位向具有不同之能量:平行的位向較低,如Fig.4所示。(5)
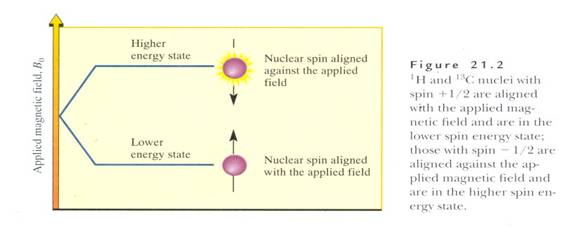
Fig.4 核在磁場的旋轉方向及其能量之關係-平行於磁場之位向,其能階較低
(摘自William H. Brown,Introduction to Organic Chemistry)
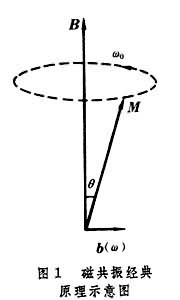
3.磁共振原理
其經典抽象描述是﹕原子﹑電子及核都具有角動量﹐其磁矩與相應的角動量之比稱為磁旋比γ。磁矩M
在磁場B中受到轉矩m![]() sin
sin![]() (
(![]() 為M與B間夾角)的作用。此轉矩使磁矩繞磁場作加速運動﹐加速度的角頻率
為M與B間夾角)的作用。此轉矩使磁矩繞磁場作加速運動﹐加速度的角頻率![]() =γ
=γ![]() ﹐
﹐![]()
![]() 稱為拉莫爾頻率。由於阻尼作用﹐這一加速運動會很快衰減掉﹐即m達到與
稱為拉莫爾頻率。由於阻尼作用﹐這一加速運動會很快衰減掉﹐即m達到與![]() 平行﹐加速就停止。但是﹐若在磁場
平行﹐加速就停止。但是﹐若在磁場![]() 的垂直方向再加一高頻磁場
的垂直方向再加一高頻磁場![]() (
(![]() )(角頻率為
)(角頻率為![]() )﹐則
)﹐則![]() (
(![]() )作用產生的轉矩使m離開
)作用產生的轉矩使m離開![]() ﹐與阻尼的作用相反。如果高頻磁場的角頻率與磁矩加速度的拉莫爾(角)頻率相等
﹐與阻尼的作用相反。如果高頻磁場的角頻率與磁矩加速度的拉莫爾(角)頻率相等![]() =
=![]()
![]() ﹐則
﹐則![]() (
(![]() )的作用最強﹐磁矩m的加速度夾角(m與
)的作用最強﹐磁矩m的加速度夾角(m與![]() 角的夾角)也最大。這一現象即為磁共振。
角的夾角)也最大。這一現象即為磁共振。
儀器基本架構
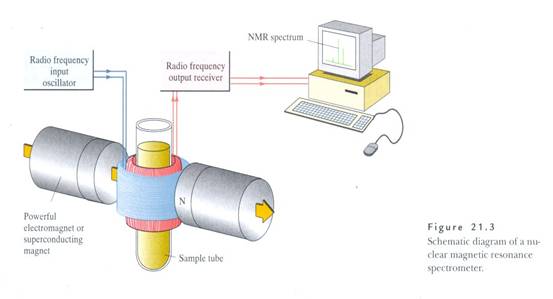
(本圖摘自William H. Brown,Introduction to Organic Chemistry)
NMR spectrometer基本組成架構有:
1.a powerful magnet:即外加之強力靜磁場
2.a radio frequency generator:產生電磁波
3.a radio-frequency detector:偵測信號頻率
4.a sample tube:呈裝樣品溶液(5)
4.研究流程
1. 樣品之備製
將樣品溶解於溶劑中,這些溶劑不含氫,因為會干擾分析,通常使用的溶劑有:tetrachloride(CCl4)、deuterochloroform(CDCl3)、deuterium oxide(D2O)。(5)
2. 進行NMR分析收集數據
3. 根據數據考量各種參數加以分析
4. 利用NOE ( Nuclear Overhauser effect )及其他數學分析方式來推算原子間距離及鍵結角度
5. 根據上列數據解出結構加以驗證反推
進行NMR分析時,各個原子本身核的特性不同,加上和周圍環境之影響,所以原子有各自的光譜,由於生物物質構造中以碳原子( C )及氫原子 ( H )組合居多,故通常都會就碳原子( C )及氫原子 ( H )進行13C及1H之分析。分析時所需考慮的參數如下:
(1) 化學位移 ( Chemical shift ) *e:和核本性、化學鍵結方式等有關。
(2) 耦合常數 ( Coupling constants )
(3) Relaxation times:和自旋翻轉的方式有關。
就這些參數加以分析,推論出結構後,再以所推測出之結構反覆回推,加以驗證。(13)
核磁共振最早用於無機、有機小分子之化學結構分析,之後被一些研究人員藉由檢驗組織中的水分來分析生物屍體。1959年,有人利用NMR測出大鼠體內之血液流速,證明NMR可用於研究活生生的動物而不傷害牠們,加上之後造影技術的發達,NMR亦廣泛的應用於醫學上,即磁振造影 ( MRI,Magnetic Resonance Image)。(1)
近年來,生物學家,尤其是生物化學研究者對NMR這項技術越來越感興趣,因為他們想要進一步了解分子的構造,通常必須靠繞射法(包括X光、中子繞射法或電子繞射法,以X光繞射法為主流)或是核磁共振光譜法才能進一步確定。(4)
X光繞射法和核磁共振光譜法,二者最大的不同處,在於X光繞射法必須先將蛋白質結成晶體後,才能進行結構上的分析,而以核磁共振光譜則可測得在溶液環境下分子的結構。因為我們知道蛋白質主要都是在溶液環境下發揮作用,且結構通常具有相當大的彈性,有時形成結晶後已與先前活化狀態的型態不同,由X光繞射法所得到的結構,並非都可正確的表現出蛋白質於活性狀態下的構形,因此用核磁共振光譜法對蛋白質結構的研究帶來很大的幫助。(4)近年來蛋白質體學發展快速,主要是因為要了解基因功能,必須先了解蛋白質如何發生作用,而要能先了解蛋白質結構,才能知道蛋白質發生作用的部位及原因;另一方面,若能快速觀察了解蛋白質與藥物結合後的情形,據以設計藥物,可大幅縮短製藥時間,同時也可充分掌握藥物作用情形,避免產生副作用。國內為了提高蛋白質結構解析速度,大大提升相關之研究設備,例如:同步輻射中心興建兩條基因體醫學實驗專用光束線及增購良好之NMR等儀器,相信未來在研究蛋白質體學時會非常便利。
鑒於質譜儀與核磁共振儀已成為現今研究蛋白質結構不可或缺的利器,2002年諾貝爾化學獎的榮耀,理所當然的落在為這領域帶來突破性發展的人士—即美國學者約翰.芬恩(John B. Fenn)、日本研發工程師田中耕一(Koichi Tanaka),及瑞士籍研究教授伍斯瑞許(Kurt Wuthrich)—以表彰他們對於鑑定蛋白質大分子結構的貢獻。其中伍斯瑞許的貢獻是在使核共振光譜法研究上,於下列一一說明。(14)
伍斯瑞許是瑞士人,西元1938年10月四日誕生於阿爾保(Aarberg),1957~1962年取得波恩(Bern)大學物理、化學及數學學士,1964年獲得巴塞爾(Basel)大學博士,留校一年從事博士後研究。1965~1967年在加州柏克萊分校繼續從事博士後研究。1967~1969年,於美國貝爾實驗士服務。1969年回到瑞士,任職於蘇黎士瑞士理工大學,於1980年升任教授迄今,並曾擔任生物系的主任五年。於2002年獲獎時正擔任美國Scripps研究所訪問教授。
1980年代起,伍斯瑞許開始以核磁共振儀測量生物體的巨分子,比對出胺基酸組成後,便以他研發出的一種系統性方法,藉由確認相鄰胺基酸上氫離子的作用,將相鄰的胺基酸匹配成對,而逐步定出蛋白質的一維結構,此法已成為今日以核磁共振儀定蛋白質胺基酸序列的標準流程。
伍斯瑞許的另外一項貢獻,是在使核共振光譜法能應用於生物巨分子磁結構的鑑定。兩相近氫原子間主要會有兩種偶極作用,一種是與是由於序列上相鄰胺基酸所造成強偶合作用;另外一種則是蛋白經適當摺疊後,兩相接近胺基酸上氫離子間之較弱的偶合作用。弱的偶合作用大小與距離的六次方成反比,此種效應稱歐佛豪瑟效應(Overhauser effect)。由歐佛豪瑟效應的關係可知,極小的距離變化就可造成極大的弱偶合作用大小變化,且越相近的氫原子弱偶合力越強,藉此可推之相鄰兩氫原子於空間上距離的關係。由於可經由比對得知哪些氫原子屬於哪個胺基酸,兩胺基酸於空間上的關係便可被訂定出來。舉例而言,兩胺基酸於蛋白質序列上可能相隔甚遠,但經由摺疊彼此靠近,經由此種測量方式便可得知兩胺基酸彼此空間上的關係,藉此可推得整個蛋白質的結構。自1985年伍斯瑞許以此種方法定出了蛋白質的三級構造以來,十幾年間帶動了相當豐碩的相關研究成果,為核磁共振儀對蛋白質結構分析帶來了重大的影響。
在此值得一提的是,核磁共振光譜法與X光繞射法在鑑定蛋白結構的分析上,其功能是互補的,雖然核磁共振可分析出液體環境下的蛋白質結構,但有些水溶性較差的大分子聚合物,如纖維蛋白等,仍只能以X光繞射法加以分析。然而核磁共振也具有其優勢,它除了可以測定水溶情況下的蛋白質結構外,還可以加以訂定出一般於X光繞設法中不易測定的動態結構;在適當的操作下,也能進一部測得蛋白分子動能及與其他蛋白互動下的情況,可為藥物篩選與蛋白分子動力的測定等開啟一扇大門。(4、14)
1.「共振」*f:當一個系統受到外界振動的干擾,而干擾的振動頻率與系統本身的自然頻率相等時,能量很有效地從振動的源頭輸入系統,使系統的振幅和能量不斷增大。(12)
2.「磁場」:為磁力作用的空閒,即在此範圍內能與其他磁性物質相互作用,見9.
磁場之詳細補充。(11)
3.「電場」:凡靜電力所能及的空間,此空間即形成電場。
4.安培右手定則:(1)以右手大拇指表示導線上電流的方向,而環繞導線周圍的四個手指,就代表磁場方向。(2)螺旋定則:以彎曲的四指表示導線上電流的方向,則大拇指的指示就是磁場的方向。(9)
5.法拉第定律:感應電流的大小和線圈內磁場變化的速率成正比。(9)
6.冷次定律:因磁場感應所生之電流,其所生的磁場永遠抵抗原來的磁場變化方向。(9)
7.Hertz(赫茲):單一完整的的電流變換或電波在一特定時間內(如一秒鐘)而完成一個完整的循環次數,就是電波變換的速率或頻率,對於這種波形的速率,由赫茲博士(Heinrich
Hertz)所發現,於是稱「每秒周數」之計算單位為赫茲(Hertz)。(8)
8.同步輻射(synchrotron
radiation):近光速行進的帶電粒子,受到磁場作用而偏轉時,會沿著行進的切線方向發出輻射,即稱為同步輻射。這種輻射脈波的強度與偏振程度很高,而且為連續光譜。波長範圍從紅外輻射、可見光、紫外輻射到X射線,因此可以獲得更多波段的訊息,是截至目前為止最優秀的研究光源,應用於高溫超導、工業觸媒、材料科學、生命科學、醫學、動力化學、晶片、紡織等研究與應用。(6)
8.磁場之詳細補充
電流﹑運動電荷﹑磁體或變化電場周圍空間裡存在的一種特殊形態的物質﹐其基本特性是對場中運動帶電粒子施加力﹐或對場中有磁矩的粒子及物體施加轉矩。因此﹐可根據這一點來描述磁場。描述磁場的基本物理量是磁感應強度B﹐它是個矢量﹐其大小和方向可根據運動電荷受到的力所遵從的洛倫茲力公式確定﹐也可根據磁矩m在磁場中受到力矩M的公式M=m×B確定。磁感應強度的單位是特斯拉(T)﹐另一個常用的單位是高斯(Gs或G)﹐1Gs=10T。
磁場是個無散度有旋度的矢量場﹐磁場可以用磁力線形像地圖示﹐磁場的磁力線是一些無源的閉合曲線組成的曲線族。又分為
1.
恆定磁場
( 靜磁場
):恆定電流
( 直流
)
或靜止永磁體產生的磁場﹐大小和方向都不隨時間改變。
2. 交變電流或運動永磁體產生的磁場﹐大小和(或)方向隨時間改變﹐稱為交變磁場(磁場大小和方向都改變)或脈動磁場(磁場只有大小改變而方向不變)。
磁場不但普遍存在﹐而且在現代生產技術和人類生活中都有著廣泛的重要應用。例如﹕利用電磁感應的發電技術中需要磁場﹐它在機械能或熱能有效地轉變為電能的過程中起著重要的作用﹔磁場使處於其中的載流導體受到力的作用﹐電動機﹑磁電式儀錶和揚聲器(喇叭)等都是利用這一磁場效應製成的﹔非均勻磁場使磁性不同的物體受到大小和方向不同的力作用﹐是磁力分離(包括高梯度磁分離)的物理基礎。這種磁分離技術已廣泛應用於選礦﹐煤中除硫﹐陶瓷原料中除鐵﹐水中除細菌﹑病毒和有毒物質﹐分離紅白血球等等。變化的電場產生磁場﹐變化的磁場又產生電場﹐電場和磁場相互聯繫以波的形式在空間傳播(見電磁波)。 (15 , 16)
9.參考資料
1. Betty H .Kevles著,楊玉齡譯,露骨-醫學造影檔案,天下遠見出版股份有限公司,p.p. 49-56
2. 黃良平著,核磁共振波譜儀,儀器總覽,p.p. 38-40
3. McMurry著,王健行等譯,有機化學 (全),高立圖書有限公司,p.p. 457-474
4. 王文竹,透視生物巨分子結構,科學月刊,2002,396:1033~1036
5. William H. Brown,Introduction to Organic Chemistry,2th(2000),Saunders College Publishing,p.p.587-594
6. http://www.bookzone.com.tw/newsletter/scc/epaper/epaper5.htm
7. http://www.chjhs.chc.edu.tw/srrc.htm
8. http://www.sinica.edu.tw/~ez2cclin/acoustic/1/hertz.html
9. http://content.edu.tw/vocation/control/tp_nh/ee/tp_nh/8/5.htm
10. http://www.coosnet.net/school/science.htm
11. http://140.134.44.101/nondestruction/17.htm
12. http://neko.phys.ntu.edu.tw/lectures_pages/experiments_pages/nmr.htm
13. 黃紹光,蛋白質結構與生物資訊跨領域研究及教學研討會,2003,p.16、p.27
14. 何國榮,分析蛋白質的利器,科學月刊,2002,396:1037~1041。
15. 吳大猷著﹕《電磁學》﹐科學出版社﹐北京﹐1983。
16. 趙凱華﹑陳熙謀編﹕《電磁學》﹐人民教育出版社﹐北京﹐1978。