蛋白質酵素催化特性
口述:莊榮輝 老師
整理:林佳褀、郭裕民、黃保臻、呂昀
二、酵素活性區可降低中間過渡狀態的位能
此次的目的主要是藉由酵素具有催化活性的基本原理,
以蛋白質的分子構造為基礎,了解酵素催化的化學本質
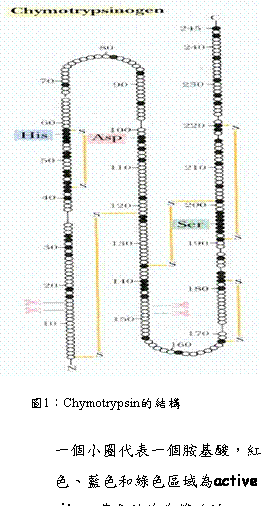
。而整個主題中,我們以chymotrypsin(圖1)當作這
次主題中的實例,chymotrypsin其active site為His57、
Asp102、Ser198 稱catalytic triad,而chymotrypsin的催化
機制(圖4)主要的步驟包含acylation與deacylation,
acylation主要是Substrate peptide 進入活性區後,會檢查
專一性位置,確定水解區域,通常為具有苯環之胺基
酸(Phe、Tyr、Trp)的C端,之後chymotrypsin中Ser
的O-會攻擊peptide上的碳,形成過渡狀態,最後
Peptide bond 斷裂,由His57提供氫離子,放出 free
peptide C,而Peptide N以acylation接在 Ser195上,
成為中間產物;而deacylation則是水分子進入活性區後
會接在His57的位置,由水分子上的氧攻擊碳原子,形
成另一個過渡狀態,並把一個氫留在Histidine上,最後
由Ser195放出所連結的N peptide,回復原來的活化狀態。
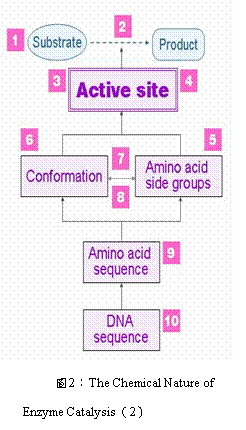
酵素催化主要的流程如下頁圖2。酵素具有催化的能力,可將基質(substrate)快速轉換成生成物(product),此過程僅需耗損少量的能量,且酵素本身並無改變。而酵素之所以有這種能力,完全是靠他的活性區 (active site)決定,活性區只能與其專一性基質結合,才能有效地催化,並且穩定『過渡狀態』的生成;而每一種酵素的特定構形(conformation)和胺基酸上的側基(amino acid side groups),則是成就此專一性結合與催化的主因,也只有在這兩個前提正確下,才會有正確的活性區;因此每一種蛋白質都具有其特定的構形及活性區,而這兩個條件在蛋白質中有著舉足輕重的地位,若構形瓦解則其生理功能喪失;而正確構形之能成形,則決定於所組成之胺基酸序列,而正確的胺基酸序列則是由基因上的核甘酸序列所決定,故酵素催化的源頭為DNA。
2.酵素催化的調控點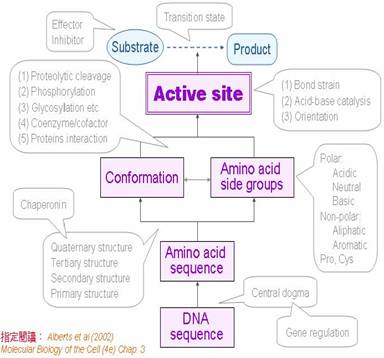
酵素催化中的每一步驟又有許多機制來調控,經整理過後可以主要分為下列十個原理:1.酵素活性區與其基質有專一性結合2.酵素活性區可降低中間過渡狀態的位能3.酵素的活性區是一個凹陷口袋並具有特定分子構形4.酵素的催化機制可歸納成三種基本動作5.胺基酸側鏈基團的化學特性對蛋白質構形與功能有重大影響6.蛋白質分子構形的組成有四個層次7.蛋白質有種種修飾方式以便調節其功能8.蛋白質的『功能』與其分子構形有關9.胺基酸序列藏有最終蛋白質功能的大部分信息
(但非全部)10.蛋白質的胺基酸排列是由其基因的核甘酸序列所決定;所決定之部分各標於圖3中,各詳述如圖:
圖3:酵素催化的詳細流程圖
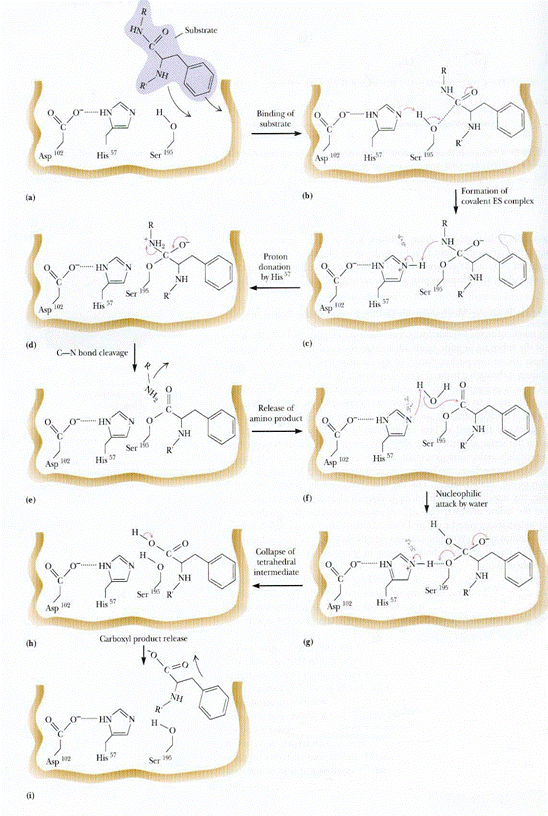
圖4:Chymotrypsin催化的機制(1)
酵素之催化始於酵素與基質之結合,這種結合是具有專一性的,酵素的催化能力源自於其分子構形與化學特性,以chymotrypsin為例,其活性區主要為catalytic triad (His57、Asp102、Ser198),其專一辨認區位在附近,基質會與此區域結合,稱protein-protein interaction,主要是構形上的互補(鑰匙與鎖之原理),其中,酵素和基質的接面會產生吸引力吸引,這些吸引力主要是二級鍵(secondary bond)所產生,包括凡得瓦爾力-van der waal,疏水鍵- hydrophobic interaction,氫鍵- hydrogen bond和離子鍵-ionic bond,這些二級鍵主要是靠數量多來進行結合,優點為易吸易落(魔鬼粘的概念),因此其所需的能量較少。
二、酵素活性區可降低中間過渡狀態的位能
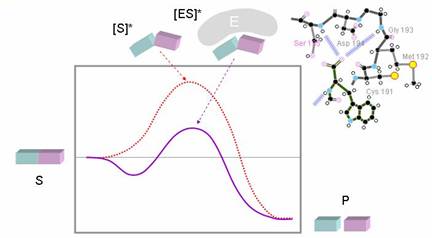
圖5:在有酵素存在下,可降低形成中間產物的位能(2)
酵素可催化共價鍵的生成或斷裂。通常在沒有酵素的存在下,必須耗費很大的位能來使基質(S)轉變成生成物(P),而在一般的狀態下,這個位能很難達到,因此不太容易自動變為生成物。但若有酵素存在的狀態下,基質與酵素(E)結合後,酵素活性區的構形會誘導基質轉變成過渡狀態,並且穩定此過渡狀態,之後轉變成生成物(圖5)。以 chymotrypsin 為例,在中間過度狀態會產生過多的負電,而Ser195附近有histone可中和負電,穩定過渡狀態,加速反應進行。
酵素活性區主要有四項功能(1)可穩定過度狀態:因為可以中和正、負電(2)防止水分子干擾:必須避開環境中的水分子,因為水具有非常強的水合能力和界電常數,會干擾催化反應(3)活性區內的胺基酸具高反應基團,可直接或間接參與催化(4)具有輔脢或輔因子加強催化反應。因此酵素可與基質結合並促成中間過渡狀態的生成。
大多酵素都是取用三種基本動作(1)空間方向-orientation(2)化學轉移-acid-base transfer(3)構形扭曲-bond strain,經過排列與組合後,完成自己特定的催化流程。其中 bond strain 與 orientation 都是以空間上的限制,而acid-base transfer則是化學性的 electrophilic 或 nucleophilic 攻擊反應,也只有酵素活性區可以同時存有酸鹼催化
。
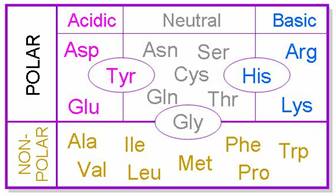
圖6:胺基酸的特性分類(2)
胺基酸為構成蛋白質的基本單位,而構成胺基酸的兩大部分為胺基酸骨架和側鏈基團,而側鏈基團的反應都不強,又因為支鏈的不同可以使胺基酸分成極性及非極性兩大類,其中極性又有酸性(正電)、鹼性(負電)及中性(不帶電)三類(圖6),每一大類中有各種不同長短的側鏈,共同組成各種不同的蛋白質分子。不同的基團的極性或非極性,以及其在蛋白質中的排列位置,就會影響最後整個蛋白質構形的穩定性、功能和活性。
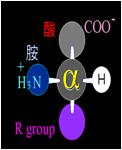
蛋白質構形是由胺基酸連接起來,我們可以利用人為區分的方式將蛋白質分為一到四個層次(圖7),其中蛋白質的一級構造為(N-Cα-C)n的重複序列所構成基本骨架(圖8-a)。在α碳上周圍的四個位置分別填上一個氫原子、胺基、羧基及一個R基團,且這幾個分子會形成一個平面(圖8-b),而這個平面是不能扭曲的,
![]()

(a) (b)
圖8:(a)蛋白質骨架的組成 (b)胺基酸的基本分子結構 (2)
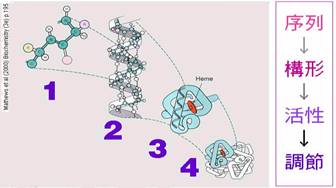
依此類推連成一條長的胺基酸鏈,而此長鏈藉由胺基酸上-OH原子所形成的氫鍵就會捲曲成 α helix和 β sheet,形成蛋白質的二級構造,而許多的二級構造藉由二級鍵(氫鍵、離子鍵、疏水鍵)和雙硫鍵可組成一個完整的蛋白質分子,即為三級構造,又有些蛋白質會利用三級構造堆疊成四級構造,是其具有更複雜的生理功能(如:血紅蛋白)。蛋白質分子構形可分為四層次,分別為序列-構形-活性-調節,其中序列指的為一級構造,構形則指的是三級構造,蛋白質因為有了固定的構形,產生了催化活性或生理功能,至調節的層次時,已經達到了四級構造,分子似乎會有辨識的能力,知道何時該有活性。
蛋白質合成後,需要再經過修飾的動作才有具有完全的活性,這些修飾的動作包括(1)Phosphorylation:在20個胺基酸並無磷酸根的出現,主要是因為磷酸根的基團太強,因此才在蛋白質的構形形成後再加以修飾,避免擾亂胺基酸的合成(2)Glycosylation(3)Proteolytic cleavage:如chymotrypsin在切一刀後才具活性(4)Coenzyme/cofactor:可以補足構形和基因的不足(5)Protein interaction;以上這些修飾的結果,大部分會導致整體蛋白質分子構形改變而影響酵素的活性。
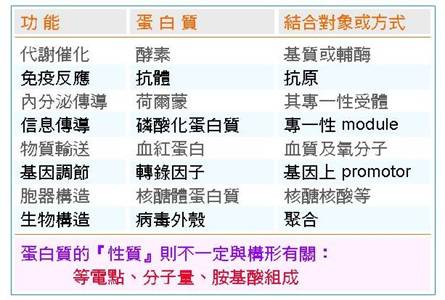 構形是決定蛋白質功能的根本因素,蛋白質要維持正確構形,才能與其他大小分子產生專一性的結合,以便進行下一步的催化或功能,達成細胞的生理需求(圖9)。而蛋白質的『性質』的確與構形無關,例如等電點或分子量,不管蛋白質的構形是否正確,大概都不會變化太多。
構形是決定蛋白質功能的根本因素,蛋白質要維持正確構形,才能與其他大小分子產生專一性的結合,以便進行下一步的催化或功能,達成細胞的生理需求(圖9)。而蛋白質的『性質』的確與構形無關,例如等電點或分子量,不管蛋白質的構形是否正確,大概都不會變化太多。
圖9:蛋白質的功能與其分子構形有關 ,但蛋白質的性質與分子構形無關。(2)
胺基酸序列除了決定最終的蛋白質構形之外,其自身的排列則像文字一樣,具有某些特定的意義。如澱粉磷解中的PEST區域易被裂解,而RALAIGN之區域稱之為Destruction box。因此,未來我們希望可以利用蛋白質上的胺基酸序列就可以得知蛋白質的性質及構形,目前已可由胺基酸的一級構造推得二級的結構,但對於三級以上的構造尚有進步的空間了。
DNA可藉由轉錄的作用轉變成RNA,RNA則可經過轉譯的作用將RNA轉變為蛋白質,但仍無法包含蛋白質功能的全部信息,因蛋白質仍須經修飾作用後才有功能,或甚至需兩個蛋白質交互作用才有功能,因此DNA的序列會決定蛋白質的胺基算排列的順序,並進而影響蛋白質的構形,當蛋白質擁有正確構形則會有其正常生理活性。
綜合以上Genome、Transcriptome和Proteome的概念,我們對生物學應更具有整體性的觀念,因此可醞釀出一門新的學科或觀念 - systems biology,以全方位的角度去探討整個代謝路徑對細胞活性的影響,及其所涉及的蛋白質間交互作用,或信息傳導的路徑,始能更客觀、完整的審識整個細胞或生物的表現情形。
1.Garrett,H.,Grisham,M.,1999,Biochemistry,p514&518,2nd ed.,Harcourt college publishers.
2. http://140.112.78.220/~juang/Protein/Purification/P1.htm