蛋白質水解酵素
整理: 葉孟圖、楊凱婷、施純如
1、現代的Mass Spectrometer(MS)能夠測量一個完整的蛋白質之分子重量並且有很高的正確性。既然Mass Spectrometer可以精確的測量完整蛋白質之分子量,為什麼蛋白質體學(Proteomics)不可以僅僅只是用MS來測量呢?原因有三:
(1)MS在測量時仍然會產生測量時的錯誤,愈大團的蛋白質,誤差也就愈大,這些錯誤足以讓儀器測量的正確性無法達到標準定義,此外,不同的後轉譯的修飾(Posttranslational modifications)會使蛋白質變得更複雜,因此造成測量上的錯誤,
(2)不是每個蛋白質都能夠用mass spectrometer(MS)測量,對於一些非常大或疏水性(hydrophobic)的蛋白質都不易測量。
(3)利用peptide來做分析或串聯質譜儀peptide tandem Mass的分析比利用完整的蛋白質分析較清楚也較精確。
根據以上原因,目前在做蛋白質體學研究時,要做完整的蛋白質分析仍具有較大的不可行性,因此我們必須利用蛋白質水解酵素(protease)將完整的蛋白質分子切成小分子胜肽(peptides),增加分析的準確性。
2、有兩個原因來解釋為什麼peptides分析優於protein分析:
(1)MS儀器目前來說很適合做peptide分析,能執行高正確率的測量, 也能找尋peptides真實的序列。
(2)從peptides的MS分析得到的資料能夠直接從蛋白質資料庫(protein database)或核苷酸序列資料庫(nucleotide-sequence database)做直接的比對。
1、peptide片段介於6-20個胺基酸對於MS的分析及資料庫的比對最為理想。
2、少於6個胺基酸的片段是太短而無法產生特殊獨特的序列來跟資料庫作比對,因此需要利用適當的酵素將蛋白質切成最適合分析的大小片段。
3、peptide大於20個胺基酸的長度在tandem MS分析也是困難的,因此當利用其中一種蛋白質酵素作用之後,peptides仍大於20個胺基酸,需要利用另一種酵素作用,將蛋白質分且成最適當的大小來進行分析。
因此,protein digestion的目的將會製造最大量、最適當的peptide長度來作MS的分析。
自然界中有不同的蛋白酶(protease),而這些protease對於高等生物來說是作為蛋白質修飾(protein remodeling)不可或缺的,雖然有數千種的protease被純化或知道其表現特徵,但是大部分酵素的量都有所限制,只有那些懂得protease的生化學家能夠純化它們,表現它們。再做蛋白質體學研究時,所利用的酵素要很穩定,要很純不含任何的雜質,而且必須在任何情況下能夠有完整的作用。
下列表格列舉一些常用於proteomic分析的protease。
|
酵 素 |
特 殊 切 點 |
|
Trysin |
切Lys的C-terminal , 切Arg的C-terminal , 切Pro的N-terminal |
|
Chymotrysin |
切Trp的C-terminal , 切Tyr 的C-terminal , 切Phe的C-terminal , 切Pro的N-terminal |
|
Glu-C(V8 protease)* |
切Glu的C-terminal , 切Asp的C-terminal , 切Pro的N-terminal- |
|
Lys-C |
切Lys的C-terminal, 切Pro的N-terminal |
|
Asp-N |
切Asp的C-terminal |
註:紅字代表要存在於sodium phosphate buffer中
*
V8 protease是由金黃色葡萄球菌V8分離出來的,在磷酸鈉(sodium
phosphate)緩衝液中,
切於aspartate
和
glutamate之後,其它溶液中只切於glutamate之後。
1、Serine protease
屬於Ser一族的嗜鹼性蛋白脢,是利用 catalytic triad (Asp-His-Ser)的活化型,主要以 Ser195 來進行催化反應,整個過程可以由圖1來說明,因此其催化機制都相同,即使催化機制相同,但它們在蛋白質上所辨別的胺基酸種類不同;這是因為每種 Ser protease 分子上,除了 catalytic triad 外,都還有一個基質辨認區,可以專一性地與所嗜好的胺基酸基團結合。
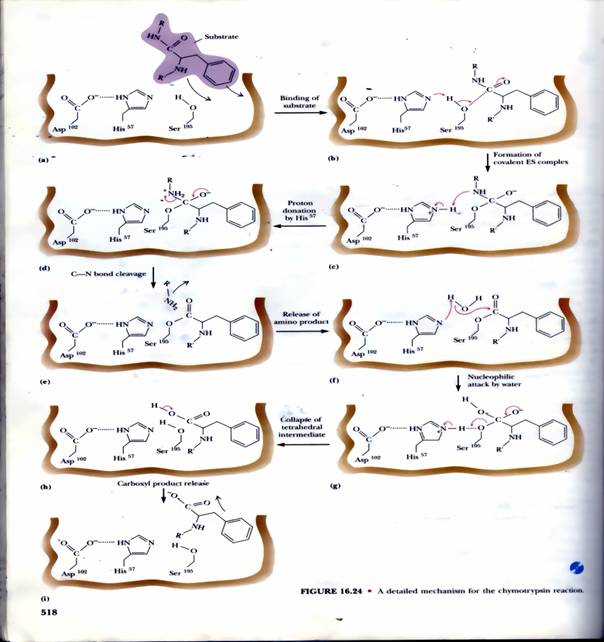
圖1:Serine protease 的主要作用機制-基質的結合->形成ES複合物>His57提供氫離子->釋放胺基酸端產物->水提供氫離子->中間產物的裂解->釋放碳端產物(1)。
(1)Trypsin
因為有如此的異同點 (催化機制相同,基質辨別區不同) ; 因此有人改變了一個蛋白酶的專一性結合區 (chymotrypsin),而得到具有另一種專一性的蛋白脢酶(trypsin)。
蛋白酶有很多屬於蛋白質類的抑制劑,此種抑制劑也會與蛋白酶結合,而蛋白酶雖然可以水解此抑制劑,但被切開的抑制劑會留在蛋白酶上,形成極強的鍵結,因此抑制了蛋白酶的催化活性。 例如 trypsin 有很多來源不同的抑制劑,在卵白中有一種稱為 CHOM 的蛋白質,對 trypsin 具有專一性的抑制與結合作用。
做蛋白質體學研究時,應用非常的廣泛,某些特定蛋白質分解酵素,例如Trypsin可以將蛋白質分子中某些特定胺基酸(如Arginine及Lysine)分解,使每一個蛋白質被切割成為一群獨特的、大小不同、質量不一的胺基酸片段。此一群胺基酸片段的質量數目組合(比如六個胺基酸片段,其質量分別為474、587、652、883、921 及1034),對其原來未被切割的蛋白質分子而言,就如同指紋對於每一個人一樣,具有獨特性,重覆的機會非常小。所以當我們試圖瞭解這是何種蛋白,就得利用質譜儀的方法,把蛋白質經過en酵素的處理,通常以trypsin做處理,trypsin可把蛋白質切成不同的片段,有點像限制酶(restriction enzyme)切DNA,trypsin digest出來的蛋白質,會呈現五個片段,每個片段的分子量一定固定,為peptide的fingerprint,我們便可以從fingerprint比對資料庫,對應出這個蛋白質是哪一個蛋白。
在蛋白質資料庫越來越完備的情況下,幾乎每一個基因所製造出來的蛋白質的胺基酸序列,及其被胰蛋白脢切割成所形成胺基酸片段的質量數目組合,皆可以利用生物資訊學發展出的分析軟體加以預測。其中,Trypsin有一個很好的優點就是,無論是在 in solution 或 in gel digestion展現良好的活性;因此,在二維電泳膠片上所分離之上千種蛋白質,可以分別取出並利用胰蛋白酶切割成胺基酸片段,送入質譜儀分析這些胺基酸片段的各別質量。質量決定出來後,直接將這些質量數目組合輸入資料庫(胰蛋白脢切割所有已知蛋白質所形成的胺基酸片段的質量數目組合資料庫)內比對,立刻可以得知蛋白質的身份。
在蛋白質體學的分析中,trypsin是用得最多的蛋白酶,它是一種水解serine胺基酸的酵素,主要來源是牛的胰臟,優點是易於純化得到較多的產量。為了抑制它隱藏的chymotrypsin活性,一般可以用tosylphenylalanylchloromethane(TCPK)加以修飾。Trypsin的切點在蛋白質lysine和arginine C-terminal的部份,不過,如果這兩個部份在C-terminal方向連接的是proline,它就不會水解這個地方的鍵結,反而水解proline的N-terminal。由於許多蛋白質中富含lysine和arginine這兩種胺基酸,所以typsine作用之後得到的片段,很適合用於質譜儀分析,一般而言,50kDa的蛋白質用trypsin切了之後,約可以產生30個peptides。
無論是在溶液中,或是在電泳膠體上,甚至是轉印(transfer)後的硝化纖維膜上,trypsin的作用活性都很好,這也是它被廣泛使用的原因。
(2)、Glu-C (V8-protease)【全名:staphylococcal V8 protease】
(a)Glu-C即 staphylococcal V8 protease 是由金黃色葡萄球菌外分泌蛋白(extracellular protease of Staphylococcus aureus)而來,很類似哺乳類的serine proteases,因此和Serine protease在序列上有同源的特徵,此外 V8 protease之間並沒有雙硫鍵互相連接,這是和哺乳類的serine proteases不一樣的地方(可能是演化的關係)。
(b)在碳酸氫銨(ammonium bicarbonate)或醋酸胺(ammonium acetate )的緩衝液中,Glu C可以切glutamate的carboxyl端,在磷酸鹽緩衝液(phosphate buffer)中,它切點變成glutamate和aspartate的carboxyl端。這種酵素主要作用於膠體中,和trypsin比起來,Glu C的切點特異性較高,因此作用時多可保持peptide片段的完整性,不會被切得很碎,假設有一蛋白質的某部份lysine和arginine含量很高,使用trypsin會導致切得的片段過短,此時就可以考慮用Glu C,切出來的片段不會過小而不能分析。
(c)V8 protease的作用環境與原理:
專一性:
分解Glu-X和Asp-X之間的月生肽鍵在磷酸鹽緩衝液(phosphate buffer)中或是Glu-X 之間的胜肽鍵在 ammonium bicarbonate buffer,或ammonium acetate,但是接在Glu或Asp旁的X胺基酸不可以為Proline。
適合pH值環境:
4.0-8.0
穩定性:
酵素在0.2% SDS(sodium dodecyl sulfate), 1 M guanidine hydrochloride and 4 M尿素( urea)具有活性。有些活性能維持到100 C。酵素不會受二價離子的影響,通常仍會加入EDTA(ethylenediaminetetraacetic acid)。
製備方法:
分裂Glu-X 的鍵:
將substrate溶入100 mM ammonium bicarbonate at 10 g/l. 加入酵素1:30 作用2-18 hours at 37 C。
分裂Glu-X和Asp-X 的鍵:
將substrate溶入100 mM phosphate buffer (pH 7.8) at 10 g/l. 加入酵素1:30作用2-18 hours at 37 C. (2)
(3)Chymotrypsin
(a)分子構造: CT 的分子量為 25 kD,含三條胜肽,由兩個雙硫鍵連接,是 轉譯後修飾的產物;剛轉譯出來的完整胜肽鏈沒有活性,要在接近 N-端的 Arg 15 與 Ile 16 之間先斷開後,CT 才能活化。
(b)催化活性: CT 可水解胜肽鏈上面的芳香族胺基酸 (Tyr, Phe, Trp) 或 Met (具較大非極性基團者),切開這些胺基酸 C-terminal的胜鍵,是一種內切酶。
(c)活性區: CT 大部分的極性胺基酸都露在分子外表,只有三個在活性區內,對催化反應扮重要角色 (Ser 195, His 57, Asp 102)。三者以『電荷接力』形成 高反應性 Ser:其 Ser 195-OH 基上的 H+ 被鄰近的 His 57 吸收,生成具有高反應性的 -O-。
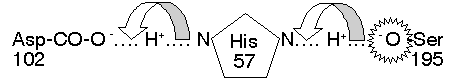
圖2、Ser 蛋白脢催化區上由三個胺基酸所構成的電荷接力(4)
(d)催化機制: Ser 上的高反應性 -O - 會攻擊基質胜肽上的 carboxyl 碳 (帶微正電),形成新的 C-O 鍵 (acylation 步驟),同時斷開基質的胜鍵,先釋出一段 C-terminal的胜肽;然後加水分解,破壞此 C-O 鍵 (deacylation 步驟),釋出另一段 N-terminal胜肽。以上兩個步驟,依次順序發生。
2、Aspartic protease
在酸性環境下具有活性,且2個Asp胺基酸為主要參與反應的地方,促進蛋白質分解的主要活性區域。
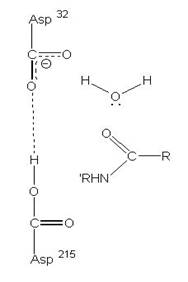
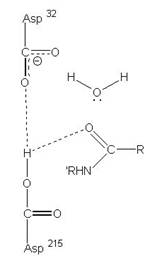
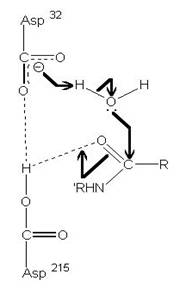
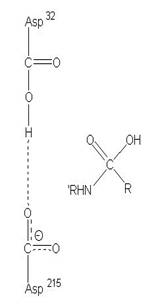
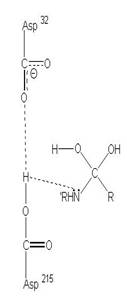
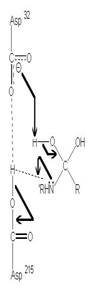
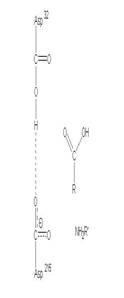
圖3:Aspartic protease作用機制-在此機制中,Asp32的角色維鹼,主要在接收氫離子,Asp215為酸,主要在提供氫離子,在Asp32接收由水提供的氫離子,Asp215提供基質carboxyl端的氫離子時,使的基質和水分子形成二水胺基化合物(amide dihydrate),之後Asp32在接受amide dihydrate的氫離子,Asp215提供基質胺基端的氫離子,造成amide dihydrate的分解(7)
(1)Asp-N
即Asp proteas,分子上有兩個 Asp 基團,以便抓住水解所需的水分子,為一種Endoproteinase,切在Asp的C端,其穩定性、專一性和所須配置的buffer如下:
專一性:
分解X-Asp或X-cysteic acid 或是 X-Glu 的月生肽鍵。
適合pH值環境:
7.0
穩定性:
酵素在2M urea具有活性。酵素活性會很快喪失。Freeze-thawing cycles不被使用在此酵素溶液中。
製備方法:
溶入substrate到50 mM phosphate buffer (pH 7.0). 加入酵素1:20 作用4-18小時在 37 C.(8)
3、Other Protease and Cleavage Reagents
Lys C、以及其它一些切點非特異性(nonspecific)的蛋白酶(Subtilysin、pepsin、proteinase K和pronas)偶爾也用於蛋白質體學研究中。其中有些只切少數、甚至只有一種氨基酸,切點很少,因此酵素作用完,得到的peptide片段較大,往往不適用於質譜儀分析;相反的,chymotrypsin因為同時會切tyrosine、phenylalanine和tryptophan這些胺基酸的carboxyl端,切點過多,產生的peptides太短,也不適合分析。所以這些蛋白酶,只在特殊情況下使用,例如某個我們有興趣的蛋白質片段,本身不帶有trypsine的切點,便能使用這些較不常用的酵素(9)。
(1)Lys-C
為一種Endoproteinase,切在Lys的C端,其穩定性、專一性和所須配置的buffer如下:
專一性:
切在Lys-X bonds;有些在Asn-X bonds會具有活性。
適合pH值環境:
在8.5-8.8 之間
穩定性:
酵素活性:在 0.5% SDS 和 5 M 的尿素(urea)濃度中最具活性
製備方法:
將溶質溶解在含100 mM ammonium bicarbonate (10 g/l)中,並加入1:50 的酵素,然後培養兩個小時;之後再次加入等量的酵素並培養22個小時(6)。
(2)Subtilisin
Subtilisin是另外一種serine protease. 它除了與chymotrypsin一樣都有Ser-His-Asp catalytic triad之外, subtilisin與chymotrypsin並不相似. Subtilisin與chymotrypsin主要不同處在於:兩者之間的結構不同。雖然Subtilisin與chymotrypsin的結構不同, 但是兩者的catalytic triad卻仍保有一些相似性。Subtilisin的catalytic triad是在Ser221, His64, Asp32; 而chymotrypsn的catalytic acid位子則是在Ser195,His57,Asp102。

圖3、Subtilisin的修飾及其活性變化(4)
(3)Pepsin
為胃蛋白酵素,可降解蛋白質為較小的聚胜片段;其中胰蛋白酵素能水解Lysine或Arginine的carboxyl端。
(4)Pronase
鏈黴蛋白,對一般穀物蛋白質均具有水解效果,但對燕麥蛋白質則例外;且對含高量單寧之高梁蛋白質具有較佳之水解效果。
(5)Papain
從木瓜提煉而得的木瓜酵素有 雙硫鍵結構,使用時會產生類似硫磺的味道,去蛋白時間約為15分鐘至四小時。
CNBr(Cyanogen Bromide)
蛋白質的水解也可以利用化學試劑來使用,其中以CNBr使用最普遍,它可以切在Met 胺基酸,這是它最大的專一性,但是它切出來的片段,通常比其他proteases相對地來得較少也較大,所以在要作MS分析之前,還需要和別的proteases加以作用。此外,CNBr為毒性物質,使用後必須回收處理(9)。
1、Garrett and Grisham, 1999, Biochemistry, 2nd edition, p518, Saunders College.
2、http://prowl.rockefeller.edu/recipes/sproteas/endoglu.htm
3、http://www.brc.ntu.edu.tw/~juang/BCbasics/Enzyme5xx.htm
4、.http://ac220.ac.ntu.edu.tw/BCbasics/Protein1.htm
5http://memo.cgu.edu.tw/research/corelab/%E8%9B%8B%E7%99%BD%E8%B3%AA%E9%AB%94%E5%AD%B8%E7%B0%A1%E4%BB%8B.htm
6、http://prowl.rockefeller.edu/recipes/sproteas/endolys.htm
7、http://www.isat.jmu.edu/users/klevicca/isat454/mech.html
8、http://65.219.84.5/prowl/aainfo/recipes/sproteas/endoasp.htm
9、Daniel C. Liebler, Introduction to Proteomics : tool for the New Biology, 2002, Humana Press Inc. New Jersey.