胺基酸性質
整理:劉家媛、簡惠燕、許棠閔
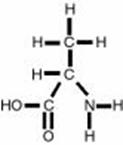
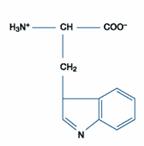
胺基酸(amino acid)的化學式結構中,因為含有一個氨基(-NH2 group)以及一個羧酸基(-COOH group)而得名。目前在生物中找到的胺基酸種類有許多種,都是因為殘基(residue,即R group or side chain)的不同所以有所變化及獨特的特性。
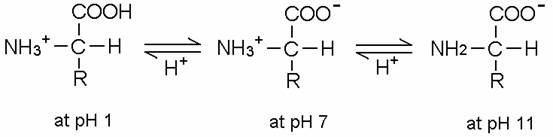
圖一 胺基酸在不同pH值的解離狀態。
遺傳密碼表中包括了64個遺傳密碼(genetic codon),其中有三個終止密碼(stop codon),其餘61個遺傳密碼可以決定出20種胺基酸,此即為研究上所說標準胺基酸(standard amino acid)。在生物體內也可找到其他形式的胺基酸,可能是經由20種標準胺基酸所修飾成的(如:Hydroxyproline、Hydroxylysine、Thyroxine),或者是代謝過程中生成的產物(如:Homocysteine、Homoserine、Ornithine),但不能直接由遺傳密碼所決定,故這些胺基酸稱為非標準胺基酸(non-standard amino acid)。
然而,最近的研究顯示,找到了第21種標準胺基酸---Selenocysteine,其化學結構式為半胱胺酸(Cys)中的硫(-S)被-Se(selenium)取代,雖然與半胱胺酸(Cys)的化學結構式相似,但Selenocysteine的合成是從絲胺酸(Ser)而來,經由特殊蛋白質辨認UGA(stop codon)作出此第21個胺基酸。
目前最常用於20個胺基酸的分類方法是依照其構造的極性、非極性及帶電性(在中性pH值時)等將之分門別類,目前常見的分類法是將胺基酸歸為四類(1):
一、極性或疏水性胺基酸:此類包括的胺基酸最多,有含丙胺酸(Alanine)、擷胺酸(Valine)、白胺酸(Leucine)、異白胺酸(Isoleucine)、脯胺酸(Proline)、甲硫胺酸(Methionine)、苯丙胺酸(Phenylalanine)、色胺酸(Tryptophan)。
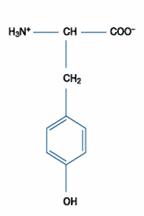
二、極性的不帶電胺基酸:此類的胺基酸比非極性的胺基酸更易溶於水。包含甘胺酸(Glycine)、絲胺酸(Serine)、蘇胺酸(Threonine)、半胱胺酸(Cystein)、酪胺酸(Tyrosine)、天門冬醯胺酸(Asparagine)、麩醯胺酸(Glutamine)等。
三、酸性胺基酸:此含有兩個胺基酸-天門冬胺酸(Asparatic acid)、麩胺酸(Glutamic acid),因其側鏈帶有羧酸基(-COOH group),在中性環境中(pH7.0)時帶負電。許多能與金屬離子結合的蛋白質多含有天門冬胺酸和麩胺酸。
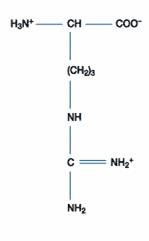
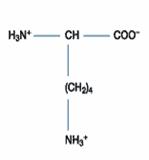
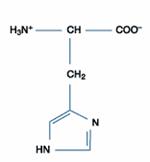
四、鹼性胺基酸:此一類的胺基酸包含三種,分別為組胺酸(Histidine)、離胺酸(Lysine)和精胺酸(Arginine),其在正常生理環境下帶正電。除了組胺酸的側鏈解離常數為6.0,接近中性pH值外,其餘二者在中性環境下均為解離狀態,因此組胺酸可做為生理緩衝溶液的成分。
胺基酸的羧基(-COOH, carboxyl group)能釋放H+,具有酸性性質而帶負電荷(-COO-),也含有氨基(-NH2, amino group)能接受H+,具有鹼性性質而帶正電荷(-NH3+),因此為一種可同時具有負及正電荷的兩性化合物(amphion),也可稱為兩性電解質。(圖一)
胺基酸也可以RCH(NH3+)COOH表示,不同的胺基酸之R分子亦不相同。若胺基酸所帶的正電荷數等於負電荷數,則淨電荷為零,此狀態下的胺基酸稱為兩性離子(dipolar ion; zwitterion)。但在較酸的條件下,胺基酸會以RCH(NH3+)COOH的形式存在,帶一正電荷;而在較鹼的條件下,胺基酸則以RCH(NH2)COO-的形式存在,帶一負電荷。當整體的胺基酸是中性的,整個系統是在一個動力的平衡狀態,此時pH值的狀態稱為等電點(isoelectric point),並以pI表示在等電點時的pH值。
胺基酸的淨電荷為正或負,受環境的pH的影響。當環境pH大於該胺基酸的pI時,胺基酸傾向於帶負電,反之則帶正電。而環境的pH大於pI越多時,則整體的胺基酸中,帶有負電荷的比例將越多。
因為不同胺基酸含有不同之R分子,其R分子亦有可解離及不可解離形式,故每一個胺基酸的等電點也隨之不同,但其pI值的求法,大致相同。將可解離基團的pKa值自小到大按順序排列,依次為pKa1,pKa2(及pKa3)。找到淨電荷為零的形式,將左右兩邊之pKa值取平均即為pI值。
pI=pH=(pKa1 +pKa2)/2
以下分別舉出中性、酸性、鹼性胺基酸各一例計算說明之。
Alanine(Ala; CH3- CH(NH2)COOH)的R為CH3,不可解離,

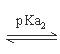

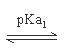
Ala之pKa1=2.4;pKa2=9.7
![]()
故Ala之pI值=(pKa1+ pKa2)/2=(2.4 + 9.6)/2=6.0
Glutamic Acid(Glu;CH2CH2COOH-CH(NH2)COOH)的R為CH2CH2COOH,可解離成CH2CH2COO-,
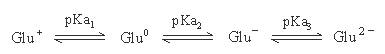
故Glu為酸性胺基酸,Glu之pKa1=2.2;pKa2=4.3;pKa3=9.7
淨電荷為零的形式Glu0,將左右兩邊之pKa值為pKa1及pKa2,
故 Glu之pI值=(pKa1+ pKa2)/2=(2.2 + 4.3)/ 2=3.25
Lysine(Lys; (CH2)4NH2 -CH(NH2)COOH) 的R為(CH2)4NH2,可接受H+成(CH2)4(NH3)+,
故Lys為鹼性胺基酸,Lys之pKa1=2.2;pKa2=9.0;pKa3=10.5
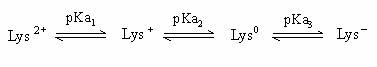
淨電荷為零的形式Lys0,將左右兩邊之pKa值為pKa2及pKa3,
故Lys之pI值=(pKa2+ pKa3)/2=(9.0 + 10.5)/2=9.75
下表為各胺基酸之解離常數。
|
Amino Acid |
-NH3+ |
-COOH |
Side chain |
pI |
|
Glycine, Gly, G |
9.6 |
2.34 |
|
5.97 |
|
Alanine, Ala, A |
9.69 |
2.35 |
|
6.02 |
|
Valine, Val, V |
9.62 |
2.32 |
|
5.97 |
|
Leucine, Leu, L |
9.60 |
2.36 |
|
5.98 |
|
Isoleucine, Ile, I |
9.68 |
2.36 |
|
6.02 |
|
Serine, Ser, S |
9.15 |
2.21 |
|
5.68 |
|
Amino Acid |
-NH3+ |
-COOH |
Side chain |
pI |
|
Threonine, Thr, T |
10.43 |
|
6.53 |
|
|
Lysine, Lys. K |
8.95 |
2.18 |
10.53* |
9.74 |
|
Arginine, Arg, R |
9.04 |
2.17 |
12.48* |
10.76 |
|
Histidine, His, H |
9.17 |
1.82 |
6.0* |
7.58 |
|
Aspartic Acid, Asp, D |
9.82 |
2.09 |
3.86 |
2.87 |
|
Asparagine, Asn, N |
8.08 |
2.02 |
|
5.41 |
|
Glutamic Acid, Glu, E |
9.67 |
2.19 |
4.25 |
3.22 |
|
Glutamine, Gln, Q |
9.13 |
2.17 |
|
5.65 |
|
Phenylalanine, Phe, F |
9.13 |
1.83 |
|
5.48 |
|
Tyrosine, Tyr, Y |
9.11 |
2.20 |
10.07 |
5.65 |
|
Proline, Pro, P |
10.60 |
1.99 |
|
6.10 |
|
Tryptophan, Trp, W |
9.39 |
2.38 |
|
5.88 |
|
Methionine, Met, M |
9.21 |
2.28 |
|
5.75 |
|
Cysteine, Cys, C |
8.33 |
1.71 |
10.78 |
5.02 |
以下分別列出20個胺基酸的中英文名字、英文縮寫和簡述
|
胺基酸名稱 |
三個字縮寫 |
縮寫 |
簡介 |
|
甘胺酸 Glycine
|
Gly |
G |
最簡單的胺基酸,為非必需胺基酸,是唯一沒有DL形式的胺基酸。缺乏β-碳,造成蛋白質結構有較大的彈性及結構空間,並抑制蛋白質(膠原蛋白)中α-helix的結構在蛋白質中偏好形成β-sheet及β-turn,並造成膠原蛋白(collagen)之triple
helix的結構,殘基的氫原子可與鄰近生肽鍵 |
|
丙胺酸
|
A la |
A |
非必需胺基酸,為非極性分子,是蛋白質中含量最充足的胺基酸,為弱疏水性,在實驗室中常被選作測試特殊致癌實驗的觀察對象。β-Ala會衍生形成輔酶A(CoA),D- Ala存在某些細菌之細胞壁或某些抗生素中,Ala藉著丙胺酸之轉胺酶後變成丙酮酸(pyruvate),在肌肉中扮演著運送NH3+的角色。
|
|
擷胺酸 Valine
|
Val |
V |
在β-碳上的甲基取代物具中度疏水性,使這個疏水性殘基降低彈性,並阻礙與鄰接生肽鍵的化學反應。特別是當鄰近的生肽鍵也含有β-碳分枝的側鏈,如擷胺酸(valine)或異白胺酸(isolucine)時。
|
|
異白胺酸 Isoleucine
|
Ile |
I |
跟擷胺酸(valine)一樣,其β-分枝的側鏈也會阻礙與鄰近生肽鍵(peptide bond)的反應。此疏水性的側鏈喜歡藏在摺疊後的蛋白內側,其β-sheet二級結構也能比α-helix快速的提供側鏈。異白胺酸有個二級的不對稱中心。它會由β-碳為中心翻轉形成L-alloisoleucine,成為物理化學特性皆不同的雙立體異構物。
|
|
白胺酸
|
Leu |
L |
是球狀蛋白中最常見的一種胺基酸,具有大型疏水性側鏈。其特徵是提供大量的aliphatic側鏈以構成蛋白質疏水性中心。白胺酸亦是以螺旋形式穿透細胞膜的蛋白上之主要調控部位,以leucine zipper的規則型態,疏水端分布在同一側。
|
|
苯丙胺酸
|
Phe |
F |
苯丙胺酸的大體積疏水性側鏈是構成球狀蛋白疏水性中心的主要結構,並能形成膜蛋白的運送膜區域。其苯環(phenyl ring)的弱極性可以和其他芳香族環(aromatic ring)或極性官能基產生交互作用。
|
|
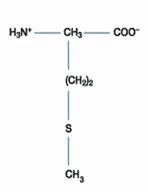
甲硫胺酸
|
Met |
M |
甲硫胺酸是含有硫的胺基酸其中之一,結構類似白胺酸,有一個大且疏水性的側鏈,但有其獨特的化學性質。其硫原子可以和其他金屬離子作用(如鋅、銅和汞),同時亦可以和氧化劑作化學反應。蛋白質中容易發現亞硫根(sulfoxide)的存在是因為體外缺乏抗氧化劑的緣故,然而在體內也有發現一些例子。氧化過後的亞硫根可進一步對其他甲硫胺酸上的硫原子作氧化作用。其上的硫原子亦可以被鹼化,但反應程度比半胱胺酸小;在酸的情況下可以和CNBr(cyanogens bromide)作用,切下甲硫肽鍵(Methionyl peptide bond)-此反應為蛋白質定序的方法。在蛋白質合成實驗中常以35S標定之。
|
|
蘇胺酸 Threonine
|
Thr |
T |
蘇胺酸是兩個帶有OH基的胺基酸的其中一個,與絲胺酸具有共同的化學及生化特性,提供O-linked做醣化及磷酸化反應。其與異白胺酸一樣具有第二個鏡像異構物中心。
|
|
絲胺酸
|
Ser |
S |
其側鏈是氫鍵的接受者和提供者,通常位在蛋白質的表面和水溶劑作用。其氧原子具有輕微的親核性,可以和強的親電性物質反應(如acetic anhycrie)。然而其親核性通常大量位在一些重要蛋白酶(the serine protease)和酯酶(esterases)的作用部位。在體內也可以和碳水化合物(O-linked glycosylation)和磷酸根形成較穩定的共價鍵。絲胺酸和蘇胺酸可逆的磷酸化反應在許多細胞生化反應中扮演了控制的訊號,在鹼性環境中,醣化或酯化的絲胺酸殘基對β-elimination敏感,可以產生脫水丙胺酸衍生物,進行進一步的反應。
|
|
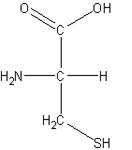
半胱胺酸
|
Cys |
C |
非必需胺基酸且為極性分子,含S原子,pKa值大約為9.0,為強親核試劑會和乙醛、醯類及烷類化藥劑反應,此為酵素的重要特性。其和鋅、鐵、銅及汞等金屬離子參與許多重要的生化反應。其存在蛋白質中會破壞α-helix中的氫鍵,其衍生物包括:輔酶A(CoA)、α-角蛋白(α-keratin)及榖胱甘肽(glutathione)。藉由氧化提供雙硫鍵來穩定很多細胞外的蛋白質,此反應在某興情況下些為可逆的,所以在實驗室中,許多的蛋白質會需要抗氧化或是抗親電的保護,以保存其功能活性。在生化反應中半胱胺酸的殘基會被醯化。半胱胺酸的殘基可參與heme的修復。在鹼性環境中可藉由β-elimination產生脫氫的 Ala,並更進一步產生羊毛硫胺酸等產物(lanthionine、lysinoalanine)以形成羊毛蛋白。
|
|
天門冬胺酸 Aspartic acid
|
Asp |
D |
天門冬胺酸pKa值約為4.0左右,羧基團在一般生理狀況下呈離子化羧酸。高極性側鏈可提供金屬離子鍵結位於蛋白質表面。特別是鈣離子或是正電荷配位體。在羧酸團和捐贈團(如guanidinium)強氫鍵可被行成。其β-羧基可直接與酵素發生反應,經由陽離子的轉換形成中間產物-acyl
phosphate。化學上,天冬胺酸的羧基酸側鏈具有典型反應,如在有活性劑(強酸或cardodimides)和親電子試劑(乙醇和胺)的參與下形成酯類和胺。因為側鏈上的羧基與α-碳上的肽鍵接近,造成與鄰近基團一些特別反用,如在稀釋酸的環境下天門冬胺酸的肽鍵比其他胺基酸的更
|
|
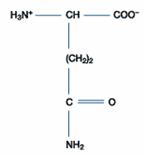
天門冬醯胺酸 Asparagine
|
Asn |
N |
非必需胺基酸且為中性極性分子,其β-醯胺基為氫鍵的提供者和接受者,所以會和水溶劑形成氫鍵,通常依序排列於蛋白質結構中。其醯胺基與其他殘基相比十分容易水解,尤其是接在像甘胺酸這類殘基較小的胺基酸後。在沒有空間障礙的情況下,會形成環醯亞胺,經過外消旋及切割之後會形成 L-或 D-的異天門冬醯胺殘基。醯亞胺容易和氫氧基反應使得生肽鍵斷裂。在真核細胞的醣蛋白中天門冬醯胺酸藉由β-carboxamide的氮原子提供N連結的醣化,其主要是細胞外或是胞膜外的蛋白。通常與天門冬醯胺酸構成glycosyl bond的胺基酸為所有胺基酸除了脯胺酸和半胱胺酸。
|
|
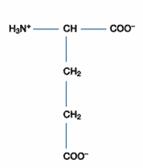
麩胺酸 Glutamic acid
|
Glu |
E |
麩胺酸殘基的羧基團比天冬胺酸有較高的pKa(大約4.5左右),但一般上兩者在蛋白質和與受質鍵結上有類似的功能和特性在於提供靜電和氫鍵結反應,包含金屬離子。但麩胺酸殘基不具有一般縮胺酸鍵的能力,在酸性蛋白酶他們也不是主要的活性位殘基。在體內修飾γ-carboxyglutamic acid 殘基的作用對有血液凝結功能的蛋白質來說是極重要。
|
|
麩醯胺酸
|
Gln |
Q |
非必需胺基酸且為極性分子,血液中含量最多者,可攜帶2分子NH3+,參與嘌呤及嘧啶的合成。分子結構和天門冬醯胺酸(Asn)相似,其醯胺的酸性較天門冬胺酸(Asp)弱,且其殘基較天門冬醯胺酸(Asn)不穩定。有些甘胺酸(Gln)經過其轉胺酶之後可和離胺酸(Lys)結合。
|
|
精胺酸 Arginine
|
Arg |
R |
在所有生理有關的pH值下,強鹼(pKa約為12.0)的精胺酸殘基為解離的形式存在。精胺酸殘基對於蛋白質的功能一般在於正電荷團和大量的氫鍵,提供高度的極性與負電荷配位體鍵結,例如磷酸和磷酸酯類包含核酸。和離胺酸殘基一樣,精胺酸提供正電荷信號給膜蛋白、前蛋白(pro-protein)的切除以及細胞核與核仁定位等,這部分有關於細胞分裂。通常在中性pH值不具活性,其殘基會形成cyclic。在體內,甲基化和ADP核糖基化是重要的修飾作用,它包含三個非極性亞甲基和強鹼γ-guanido group。因其pKa值為12,精胺酸在自然情況下皆以離子狀態存在,而其離子態的guanido group為不反應態,具有共振形式。
|
|
離胺酸
Lysine
|
Lys |
K |
離胺酸殘基鹼性強度(pKa約為10.5)較弱於精胺酸。脂肪的四亞甲基團是疏水性,但質子胺團支配者親水性。當攜帶正電荷時,離胺酸殘基提供與負電荷鍵結的位置,時常包含強氫鍵。在體內,離胺酸及其氫氧基離胺酸是維持膠原蛋白三股多生肽穩定所比需的。其側鏈的化學反應包括活化酯和酸酐的醯化反應(acylation)以及醛、imidate esters和isocyanate的修飾作用。
|
|
組胺酸
|
His |
H |
組胺酸殘基-咪唑團(imidazole group)有特定的pK值約6.5,比其他蛋白質功能基團接近中性。組胺酸殘基在酵素催化反應中常常作用於質子轉移;許多酵素反應與需在pH中性左右,和組胺縮側鏈有關。兩個連結位置對於給於質子和氫鍵結,藉由咪唑環,貢獻它有力的酸鹼催化團,serine proteases就是最典型的例子。組安酸側鏈和半胱胺酸一樣請像與金屬鍵結,例如Zn2+,Cu2+和Fe2+。其親核性的咪唑團可與羧酸、酐等起化學反應,同時對光氧化反應及碘化反應敏感,此為體內的修飾作用;在體外反應,組胺酸的殘基提供蛋白質吸附質子的能力。咪唑團受到親核性攻擊必產生acetylimidazole。
|
|
酪胺酸 Tyrosine
|
Tyr |
Y |
酪胺酸所含的羫基苯使它有顯著的極性,且此側鏈在球蛋白的結構中常暴露在溶劑裡。酪胺酸在蛋白中的pKa值約在10.0左右,所以酪胺酸在生理上多屬中性pH。酪胺酸也扮演了金屬的基質的角色,如鐵離子。同時,它在氧氣中及含芳香環的碳中可與親核性的物質(如在氧中的酯類生成、芳香族的硫、氯化、碘化、硝化、與甲醛的凝聚等)結合。其在體外形成共價結的方式包括磷酸化(在細胞的功能中,形成磷酯物以提供重要訊息)、硫化;在無脊椎動物的細胞外蛋白更可與其他的酪胺酸產生鍵結。酪胺酸也是甲狀腺素的來源。
|
|
色胺酸
|
Trp |
W |
色胺酸(Tryptophan)在多數蛋白質中所佔的比例很小,其高疏水特性可以緩和其在indole NH group中的存在,而適合做為氫鍵的來源並促進與極性分子的接觸。色胺酸通常為構成結合位置的一部分,如抗體、蛋白素、溶小體等。色胺酸的indole環容易受親電性(如鹵素)的攻擊影響。以鹵素來說,氧化物的產生是經歷降解反應,如生肽鍵的斷裂。而因為色胺酸氧化的關係使原本具輕為敏感性的蛋白質範圍增廣。色胺酸具有強UV吸光值與螢光反應的胺基酸,因此它的特性可由物理化學研究法依其蛋白質結構的改變與配位體的結合而得知。此含苯環的胺基酸在UV吸光值得測量下,其pH約等於6。
|
|
脯胺酸 Proline |
Pro |
P |
脯胺酸(Proline)是唯一的二級胺基酸,其構造不易變動。雖然它是疏水性,它卻通常以緊密形式位於蛋白質表層。其不含氨基,不能參與α-helical的水合鍵結,但偶爾也會以螺旋的形式存在,以使蛋白質的螺旋軸扭轉。蛋白質中順式的peptidylproline
鍵及緩慢的順-反式轉換皆會對酵素催化的多肽摺疊有明顯的影響。在化學上,脯胺酸是不會反應的,但其鹼性肽鍵上的氮原子會對酸水解產生高度敏感性。其獨有的立體化學結構,使
|
1.Garrett, R. H., Grisham, C. M. 1999 Biochemistry 2nd p.81-p.91 Saunders College Publishing。
2.August Bock, Karl Forchhammer, Johann Heider, Christian Baron. 1991 Elsevier Science Publishers:Seleboprotein synthesis:an expansion of the genetic code