"for their discoveries concerning the structural
and functional organization of the cell"
|

|

|

|
|
Albert Claude
|
Christian de Duve
|
George E. Palade
|
|
克勞第
|
杜武
|
帕萊德
|
|
Belgium 比利時
|
Belgium 比利時
|
USA 美國
|
|
Universite
Catholique
|
Rockefeller
University
|
Yale University,
School of Medicine
|
|
de Louvain
|
New York, NY, USA
|
New Haven, CT, USA
|
|
1899 - 1983
|
1917 -
|
1912 -(1)
|
|
利用電子顯微鏡研究細胞的微構造。從小鼠肉瘤與正常肝臟分離出微粒體(microsome)加以命名,後來並闡明微粒體的細胞內膜結構;也成功分離出粒線體。
|
從大鼠的肝臟發現比粒線體小的溶?體(lysosome),加以命名;並研究溶?體在生物體內扮演的角色、性質以及與疾病的關係,發現容媒體內含酸性磷酸?(acid
phosphatase)等的作用。
|
很早就利用電子顯微鏡研究細胞的微結構,發現微粒體的膜結構、核糖體內含許多RNA等。生於羅馬尼亞,後歸化美國(2)。
|
一、前言:
細胞是組成有機體的形態和功能的基本單位,自身又是由許多部分構成的。所以關於細胞結構的研究不僅要知道它是由哪些部分構成的,而且要進一步搞清每個部分的組成。相應地,關於功能不僅要知道細胞作爲一個整體的功能,而且要瞭解各個部分在功能上的相互關係。絕大多數細胞都非常微小,超出人的視力極限,在顯微鏡發明前,關於細胞質,除去結合著細胞生理對它的某些生理功能有所瞭解之外,對結構的認識並沒有多大進展,觀察細胞必須用顯微鏡,自從1590年複式光學顯微鏡發明之後,生物微細構造的神祕面紗就逐漸的被揭開了
。但是至今光學顯微鏡的解像力由於可見光波長的特性,無法突破0.2微米(μm)的極限,而事實上光學顯微鏡理論上的解像極限也僅有0.172微米。在這種解像力下,大部分胞器的詳細構造是無法被看清楚的,為了尋求具有更佳解像的顯微鏡,科學家們終於在1930年代發展出電子顯微鏡,藉著電子本身短波長的物理特性,電子顯微鏡終於突破光學顯微鏡的極限,使許多更細微的胞器、病毒甚至DNA的分子構造呈現在人們的眼前。Ernst
Ruska也在1986年因首先 發展成功電子顯微鏡而獲頒諾貝爾物理獎。在過去半個世紀中,電子顯微鏡蓬勃而成功的應用在許多生物醫學方面的研究,加上標本的包埋、切片一套技術逐漸完善,才有了很大改變,如今電子顯微鏡的應用不但廣泛涵蓋所有的生物醫學領域,更成為病理診斷不可缺少的工具。在20世紀40年代時逐漸開展了從生化方面研究細胞各部分的功能的工作,首先使用了均質(homogenize),在適合的溶液中把細胞機械地磨碎,和差速離心(centrifugations)的辦法,將磨碎的細胞利用重力,依大小和重量的不同而分開,除細胞核而外還可以得到線粒體、微粒體和透明質等幾部分。對它們分別地進行研究瞭解到一些物質和酶的存在和分佈以及某些代謝過程在什麽部位進行。關於線粒體和微粒體這樣的一些研究指出,許多基本的生化過程是在細胞質而不是在細胞核裏進行的。這樣的方法結合著深入的形態學研究導致對細胞中的過程有越來越深刻的瞭解,其中Christian de Duve、Albert Claude 和 George Palade因其卓越的電子顯微鏡研究的成果而得到1974年的諾貝爾獎。現在讓我們來看看他們三人當年的研究成果。(1.3.4)
二、研究成果:
1.
lysosome(溶酶體)
大多數的細胞胞器的歷史,都是先由光學顯微鏡學家描述;然後隔了一段時期再將其分離及研究其生化特性。溶酶體(lysosome)是一個例外,先對其產生化的概念,然後再作形態的分析,是Christian
de Duve於1955年所發現的一種細胞器,其所含的數十種酸性水解酶執行著更新細胞結構的生物大分子,消化細胞所吞噬的異物以及加工營養物質等生理功能(8)。當他利用離心術分離粒線體與微粒體(microsomes)時,究竟是何者具有酸性的磷化酶,其結果不甚一致。有些人發現是在粒線體內,而另有些人則發現在微粒內。在粒線體的分離液中又可分為兩部分,較輕的一部分,發現具有許多種酸性磷化酶(acid
phosphatase)的顆粒,但卻沒有粒線體中的那些細胞色素氧化脢。這些顆粒包括Cathepisin,ribonuclease,deoxyribonnuclease等的酶,均非粒線體本身所含有者。由於這些酶均是水解酶,故對此一胞器命名為溶酶體。溶酶體的另一特徵是對其受質的不透過性,通常多在比較極端的
pH 下才有較高的活性,最適pH大多在5左右(8)。為避免這些酵素分解細胞內有用的物質,必須用膜將這些酵素區隔在一小體積內。也因為有這空間的區隔,才能形成極端的 pH,並加高受值的濃度,以增加分解的速率(6),因此在生體外必需用化學劑將其表面破裂後,才有酶的助能,如圖一所示,故認為必然具有一層像膜一樣的障礙物將這些酶包圍著。如將含有大量溶素體的細胞離心分離物用電子顯微鏡觀察,果然發現有很高比例的顆粒,顯然是與在粒線體中的顆粒有所差異,而且確係被膜所包著。光學及電子顯微鏡的細胞化學分析,已證實酸性磷化酶,
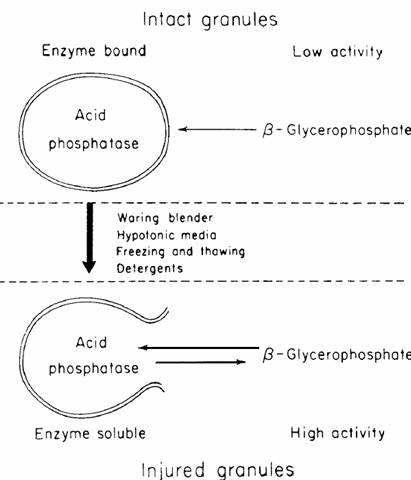
圖一(10)
在肝細胞中並非位在粒線體內,而是位在膽微小管(bile
canaliculi)旁邊由膜所圍成的濃密個體內,不像是粒線體及其他的細胞胞器,它具有一個極為清楚且易被辨識的構造。呈現酸性磷化酶活力的那些顆粒,其大小及內部構造差異很大。有些是圓球狀,中等密度,所含的酶比較單純。另一些則係不規則的外貌,密度甚高。更有一些有內含晶體物。由於顆粒之形狀與性質差異性如此之大,使得細胞學很難認為溶素體係一明確之實質體。這是無法單由形態水準去做胞器檢定的第一個例子,必須同時還要做生化上的分析方可認定。
到 1962 年止,溶酶體內所含的水解酶共計10種,此顯然係指在一般溶素體中所常見者,不同組織間必然有某種比例的差異溶,酶體只存在於動物細胞,植物細胞沒有。不過,植物細胞的液泡具有溶酶體的功能(9)。由於溶素體內含有如此多種的水解酶;自然地會認為其功能與胞內消化有關。其分解的物質,可能經由吞噬作用(phagocytosis)而獲取的外來物,亦可能是細胞本身含有的內在物,例如對某些老化的胞器及包涵物(inclusions)經其自噬而起更新作用,或是對生理活動力發生改變而產生的一種反應,將某些胞器分解之。在正常功能情況之下,由於溶素體膜的隔離而對周圍的細胞質具有保護作用,但在病態情形下,自噬作用會先將其膜分解而消除此道障礙,然後將消化脢釋放至細胞質中。分解細胞本身組成物的自噬作用的例證,可在電子顯微鏡的觀察中,發現粒線體、內質網的片段以及肝醣的顆粒,在由膜所包圍著的自噬泡(autophogic
vacuoles)內進行。其過程係被分解的胞器先由不知起源的膜所包著,然後再與溶體癒合而將分解脢添加至自噬泡內作用之。
溶酶體對外來物質進入異噬泡(heterophagic vaculoes)內的關係,可在許多種類細胞中用實驗方法而顯現出來。靜脈注射的過氧化脢,會被腎臟內的近端彎曲管的細胞,吸收至在形態上與生化上均與溶體有相同性質的吞噬泡內,如圖二(phagosomes)。肝臟內具有吞噬性的庫氏細胞(Kupffer
cells),內有許多溶體,經過氧化酶的處理後,發現這些物質都被分隔在含有酸性磷化脢的小泡,或是次級溶酶體(secondary lysosomes)內。觀察白血球的吞噬作用,對外來物質吞噬作用的機制,提供極可信任的支援。這些細胞內的顆粒均含有溶酶體般的水解酶,用光學顯微鏡可以看到這些顆粒會與吞噬泡癒合,導致這些細胞中顆粒體的逐漸減少。溶體形態上的差異性,部分係由於在進行胞內消化時,會在各種不同階段中呈現不同的外貌。顆粒較小所含的酶亦較均勻者稱為初級溶酶酶體(primary
lysosomes ),內有不具活性的貯藏形式的水解酶,故尚未開始進行消化作用。之後個體變大,內含的物質亦較非均態,可以看到有許多物質的殘渣,此時稱為異噬泡(heterophagic
vacules ),亦即吞噬泡(phagosomes)或次級溶體(secondary lysosomes ),係由初級溶體與胞攝小泡(endocytosis
vacuoles)癒合而成。異噬泡內的物質消化時,其個體就變小,形成殘餘體(residual body),內有各種不同大小密度的顆粒。不能消化的殘渣最後如何處理還不甚清楚,但在變形蟲中係由胞泄作用(exocytosis
)而排出體外,然而在較高等動物的細胞中卻沒有這種現象。取而代之係殘餘體互相癒合並濃縮,形成一個不規則形狀的構造,傳統上稱之為脂褐素顆粒。初級溶酶體之形成,被認為與分泌顆粒之形成方式類似,先是在粗面內質網上合成水解酶,然後在高基氏體中濃縮與包裝。亦有些研究者認為係起源自
GERL,即附屬在高基氏體分泌面的特化的內質網。現在已經發現在溶酶體內約有 50 種酶,包括蛋白水解酶、醣解酶、核酸酶、磷酸酶、磷脂酶及硫酸酶等。這些脢均為酸性酶,可分解細胞中大部分的組成物質,形成小分子物質後,即可透過溶體的膜而到細胞質中。由於遺傳上的疾病而無法合成其中的一種或數種的酶,會使受質在溶體內大量堆積,無法消化其內部所含的物質。
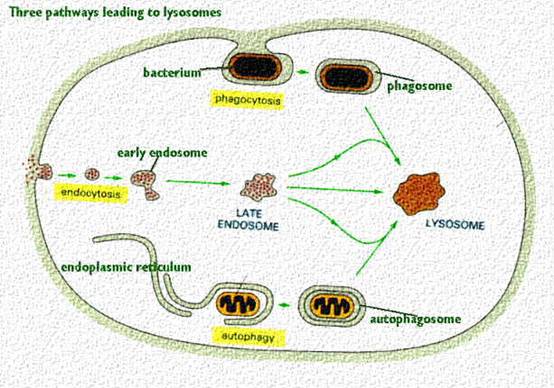
圖二 溶酶體作用的三個途徑(12)
由於溶體的功能大部分都在細胞內進行,但最近數年間已有許多證據,顯示在某種情況下,吞噬細胞會將溶體內的酶分泌出來。蝕骨細胞分泌膠原酶及一些其他的蛋白酶,涉及硬骨骨質的形成。白血球或巨噬細胞對抗體 -- 抗原接合體的附著,會刺激牠們分泌水解酶,如此可將底板(basal laminase)、軟骨介質、膠原質或彈性蛋白(elastin)等物質瓦解,導致腎臟、關節或肺的損傷。
(5.7)
2.
mitochondria(粒線體)
1898 年 Michaelis 發現在活細胞中的粒線體,可以使一種指示氧化還原的染料,將其還原。1913年Warburg
則發現細胞內某些特殊構造,具有耗氧的能力。之後的許多生化學家都對個別的胞器不甚有興趣,他們彼此產生一種傾向,認為專門注重於某一特殊組成,會對分離有關呼吸脢的努力產生障礙。由此一觀察發現一事實,即涉及細胞代謝的氧,係經過一種含鐵的催化劑,即細胞色素(cytochrome)的反應而進行。細胞呼吸中的氧化作用,係受脢中去除氫原子而得以完成。1930年代發現在細胞呼吸時,氫原子及電子在傳遞鏈的流動過程中,發現黃素蛋白(flavoprotien)係連接在脫氫脢(dehydrogenase)與細胞色素之間。之後的數年間,對於食物的氧化時,許多的脫氫反應均被研究出來了。醣類的氧化,係在反應環中進行。在此反應環內,醣分子中的碳不斷地被分解出來而形成二氧化碳,此即克氏循環(Krebs
Cycle)。同時也發現磷酸甘油醛(glyceraldehyde phosphate)的氧化是與 ATP 的合成互相搭配的,其餘的 ATP 的形成,則係在呼吸鏈中還原氧形成水解時所產生。因而顯然地,在呼吸時
ATP分子的搭配合成,稱為氧化磷酸化反應(oxidative phosphorylation),是細胞中ATP 的主要來源。
1934 年 Bensley 與 Hoerr 是第一個想從肝細胞中,利用離心法來分離粒線體的細胞學家,但並不很成功。直到1946年Claude
發現在添加 0.88M 的蔗糖後,粒線體就極易地被分離,同時還可保留其原來正常的形狀。此種技術發展出來後,對粒線體以及一些其他的胞器的功能,所獲得的知識迅速增加。粒線體中包含了幾乎所有的細胞色素氧化脢與脂肪脢。粒線體可以在生體外氧化所有TCA
反應環中的中間代謝物,同時可由以 oxidative phosphorylation而產生 ATP。之後粒線體就被認為係所有細胞活動所需的能量的主要產生地了。
(7)
圖三 電子顯微鏡下的粒線體(11)
3.
microsome(微粒體)
當細胞或組織被打破時,內質網的碎片自動形成的小泡,微粒體能利用離心分離出來,其功能大多和內質網有關,如酵素活性和蛋白質合成。
4.
ribosome(核糖體)
核糖體由兩個次單位所組成,是含有40%蛋白質和60%RNA的小顆粒體,製造的地點在核仁。核仁含製造核糖體所需的RNA及蛋白質,RNA是由細胞核的其他地方所生產的,蛋白質則是由細胞質那兒運進來的。當這些次單位被運出細胞核且接觸到m-RNA時,才會組成核糖體。
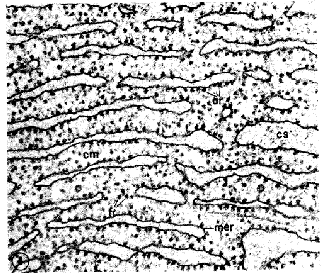
圖四 cs, cisternal space; cm, cytoplasmic matrix (cell
sol); fr, free ribosomes; ar, attached ribosomes; mer, membrane of the
endoplasmic reticulum.(15)
三、參考資料:
1.
http://www.nobel.se/medicine/laureates/1974/index.html
2.
Newton 第222期
3.
http://www.vghtpe.gov.tw/~upath/em/em.htm
4.
http://www.ikepu.com.cn/biology/biology/branch/cytology.htm
5.
http://www.nobel.se/medicine/laureates/1974/press.html
6.
http://binfo.ym.edu.tw/bch/intro/lysosome.htm
7.
http://pck.bio.ncue.edu.tw/pckweb/database/data/content/ch2/supply/2-c-3.html
8.
http://www.ibp.ac.cn/06/admission/bosses/gjzhang.html
9.
http://biosoft.biosino.org/mobio/1.4/J01_Dm.htm
10.
de Duve, C., The Harvey Lectures 59, 49 (1965).
11.
http://esg-www.mit.edu:8001/esgbio/cb/org/mito-em.gif
12.
http://cellbio.utmb.edu/cellbio/lysosome.htm
13.
http://web2.tmu.edu.tw/web2/868/8016/1-6.htm
14.
http://macro.bio.ncue.edu.tw/~8623023/teacher/message/riobosome.htm
15.
http://www.nobel.se/medicine/laureates/1974/palade-lecture.pdf