Post-translational Modification
整理:張春揚
一、多肽鏈N端和C端的修飾(Amino-Terminal and Carboxyl-Terminal Modifications)
二、移除部份序列(Loss of Signal Sequences)
三、個別胺基酸的修飾(Modification of Individual Amino Acids)
四、接上碳水化合物的支鏈(Attachment of Carbohydrater Side Chains)
五、加上Isoprenyl Groups(Addition of Isoprenyl Groups)
六、加上Prosthetic Groups(Addition of Prosthetic Groups)
七、蛋白酶的修飾作用(Proteolytic Processing)
八、雙硫鍵的形成(Formation of Disulfide Cross-Links)
在蛋白質生成的最後一個步驟,未成熟的多肽鏈(polypeptide chain)會被折疊並加工成為具有生化功能的形式,在此過程後多肽鏈將形成成熟的構造,包括了氫鍵(hydrogen bonds)、凡得瓦爾力(van der Waals)、離子作用(ionic interaction)以及疏水性作用力(hydrophobic interaction)等,此過程被稱之為post-translational modification,發生在DNA遺傳訊息已經轉譯(translation)完成之後(5)。
一、多肽鏈N端和C端的修飾(Amino-Terminal and Carboxyl-Terminal Modifications)
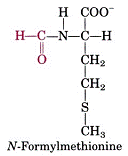
![]() 在細菌中一條多肽鏈起始的殘基(residue)是N-formylmethionine(圖一),而在真核細胞則為甲硫胺酸(methionine),此皆會被移除掉。在真核細胞更有50%蛋白質,在其amino-terminal(-NH3
group)上的胺基酸會被進行N-acetylation,有時carboxyl-terminal(-COOH
group)也會進行此修飾作用。(1)
在細菌中一條多肽鏈起始的殘基(residue)是N-formylmethionine(圖一),而在真核細胞則為甲硫胺酸(methionine),此皆會被移除掉。在真核細胞更有50%蛋白質,在其amino-terminal(-NH3
group)上的胺基酸會被進行N-acetylation,有時carboxyl-terminal(-COOH
group)也會進行此修飾作用。(1)
二、移除部份序列(Loss of Signal Sequences)

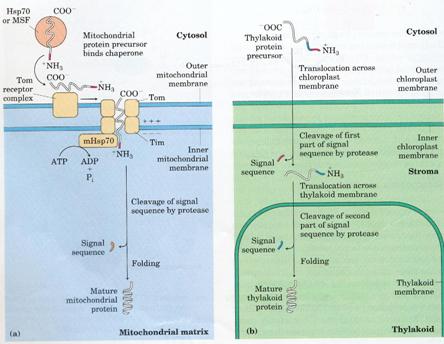
在某些蛋白質其amino-terminal的15-30個胺基酸與運送有關,而這些的signal sequence最後會被特殊的酵素移除。例如某些粒線 體(mitochondria)和葉綠體(chloroplast)所需的蛋白質(圖二),其前趨蛋白(precursor proteins)便是藉由其amino-terminal的signal sequences接到細胞質中的蛋白(cytosolic chaperone proteins),再運送至胞器膜上之受器,經由穿透膜的孔道消耗ATP或GTP進入到胞器內,在胞器中將這些signal sequences移除再重新摺疊成成熟的蛋白質。(1)
三、個別胺基酸的修飾(Modification of Individual Amino Acids)
![]() 某些蛋白質的絲胺酸(Serine)、蘇胺酸(Threonine)及酪胺酸(Tyrosin)的氫氧基(-OH
group)會被ATP磷酸化(圖三)。而這些磷酸根(phosphate
group)會增加多肽鏈的總電荷數(net
charges)。例如牛奶中的蛋白質-酪蛋白(casein),即有許多的磷酸根可以和鈣離子結合,而鈣離子、磷酸根及胺基酸對幼兒生長為必須營養物,因此酪蛋白提供了3種對幼兒生長的必需營養物。另外,許多酵素是藉著磷酸化和去磷酸化(phosphrylation-dephosphorylation
cycle)來調控其活性,如合成肝醣(glucogen)的肝醣合成酶(glucogen
synthase)必須受到protein
kinase A及ATP的磷酸化才具有活性。(1)
某些蛋白質的絲胺酸(Serine)、蘇胺酸(Threonine)及酪胺酸(Tyrosin)的氫氧基(-OH
group)會被ATP磷酸化(圖三)。而這些磷酸根(phosphate
group)會增加多肽鏈的總電荷數(net
charges)。例如牛奶中的蛋白質-酪蛋白(casein),即有許多的磷酸根可以和鈣離子結合,而鈣離子、磷酸根及胺基酸對幼兒生長為必須營養物,因此酪蛋白提供了3種對幼兒生長的必需營養物。另外,許多酵素是藉著磷酸化和去磷酸化(phosphrylation-dephosphorylation
cycle)來調控其活性,如合成肝醣(glucogen)的肝醣合成酶(glucogen
synthase)必須受到protein
kinase A及ATP的磷酸化才具有活性。(1)

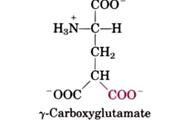
還有一些蛋白質的麩胺酸(Glutamate)會被接上一個羰基(carboxyl groups,-COO-)。例如凝血蛋白(blood-clotting protein)-prothrombin在其amino-terminal的位置包含許多γ-carboxyglutamate residues(圖四a),這些碳鏈和鈣離子結合以開啟了凝血機制。而γ-carboxyglutamate residues的產生則是需要維他命K1(圖四b)的幫忙。(1)
![]()
![]()
![]()
在膠原蛋白(collagen)中亦常見脯胺酸(Proline)和離胺酸(Lysine)經由酵素作用而接上氫氧基(-OH group)(5)。
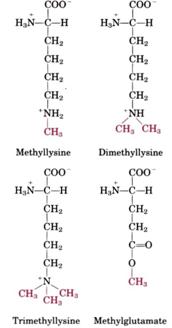
某些蛋白質的離胺酸(Lysine)會被修飾成monomethyllysine、dimethyllysine甚至是trimethyllysine(圖五)。
四、接上碳水化合物的支鏈(Attachment of Carbohydrater Side Chains)
許多醣蛋白(glycoprotein)接有多醣鏈(oligosaccharide chain),這些多醣鏈常佔其分子重量的1% - 70%甚至更多。
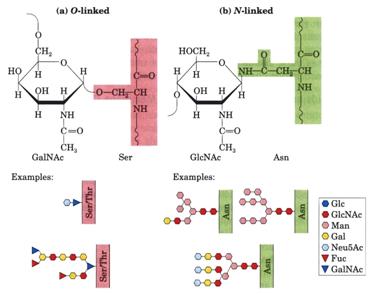
1. O-linked多醣體:碳水化合物(carbohydrate)被接到絲胺酸(Serine)或蘇胺酸(Threonine)的hydroxyl group(-OH group)上。如下圖六(a)之例子所示Neu5Ac—N-acetylneuraminic acid,又稱sialic acid。
2. N-linked多醣體:碳水化合物被接到天門冬胺酸(Asparagine)的NH2 groupg上。如下圖六(b)之Example顯示3種常見的N-linked oligosaccharide。


例如決定血型物質即為醣類結構。1901年Karl Landsteiner發現ABO血型抗原系統,開啟血液學及輸血醫學之大門。他發現不同個體間血清相互反應會造成紅血球凝集現象,這使得ABO血型系統為最早被發現的同種液體抗原(Isoantigen)也因此於1930年成為諾貝爾獎「生理及醫學獎」得主,依照此系統,人類可分為四個大類:紅血球表面有A抗原的為A型,其血清內有抗B抗體(anti-B antibodies);表面有B抗原的為B型,其血清內含有抗A抗體(anti-A antibodies);同時具有A抗原及B抗原的為AB型,血清內不含抗A抗B抗體;不具有A抗原及B抗原的為O型,其血清內含有A及B抗體(表一)。


許多科學家便致力於研究這些抗原的化學特性。A、B、O抗原特質主要決定於紅血球細胞膜上醣蛋白及醣脂質上多醣鏈末梢之特殊醣類的結構。這些抗原是由醣化作用(glycosyltransferase)的結果。
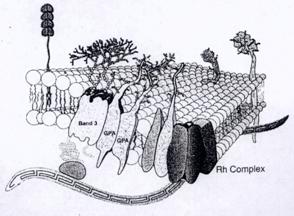
紅血球表面濃密的鑲嵌著醣類、醣蛋白及醣脂質,這些醣類對細胞的穩定度來說可能是非常重要的,但是還是有更多特殊功能的醣類不為人所知。暴露於紅血球細胞膜上的物質只要有三種,分別為蛋白質:主要為Glycophorin A、Band 3 蛋白質及Band 4.5蛋白質;脂質:構成細胞膜的主要成分,主要為磷脂質(phospholipids),而磷脂質中又以lecithin最為豐富;終端結構:Glycophorin A攜帶近一半的N-acetylneuraminic acid,而醣脂質終端也含有豐富的β-N-acetylgalactosamine及galactosyl α(1-4)galactose序列,對poly-N-acetyllactosamine來說,終端β1-4鍵結乳糖是最典型的結構(圖七)。
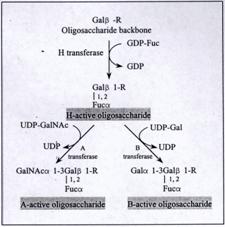
這些抗原並不是血型基因的一級產物,而是酵素作用的結果,這些酵素稱為醣化作用。分別是:形成血型O(H)的α1-2 fucosyltransferase及血型A的α1-3 N-acetylgalactosaminyltransferase或血型B的α1-3 galactosyltransferase。而GDP-fucose,UDP-acetylgalactosamine及UDP-galactose則分別是以上3個酵素的monosaccharide供應者,藉由醣轉移酵素將monosaccharide轉移至oligosaccharide骨架上(圖八)。


五、加上Isoprenyl Groups(Addition of Isoprenyl Groups)
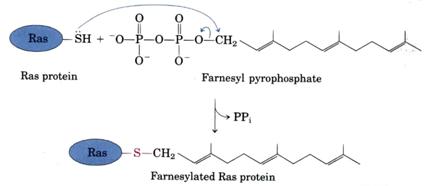
Isoprenyl group和半胱胺酸(Cysteine)間以thioesther bond做鍵結。isoprenyl group是來自isoprene的isoprenyl group。在某些蛋白質isoprenyl group可幫助蛋白質穿插於膜上。例如Ras蛋白在被Farnesyl phosphate進行isoprenylation後其活性將被抑制(圖九)。(1)

六、加上Prosthetic Groups(Addition of Prosthetic Groups)
在原核生物與真核生物中有許多蛋白質必須接上特定的prothetic group後才具有生化功能。如:acetyl-CoA carboxylase的biotin分子或是cytochrome C的heme group。(1)
七、蛋白酶的修飾作用(Proteolytic Processing)
許多蛋白質在剛合成出來時是大的且不具活性的分子,必須藉由proteolysis將之切成小的且具功能的形式。例如:胰島素(insulin)、某些病毒的蛋白質或是trypsin及chymotrypsin等蛋白酶(圖十)。(1)


八、雙硫鍵的形成(Formation of Disulfide Cross-Links)
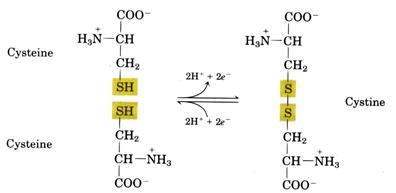
半胱胺酸(Cysteine)雙硫鍵的形成有助於蛋白質維持其穩定的結構,避免遭受到環境的破壞或是細胞內氧化(圖十一)。(1)舉例而言,人頭髮捲曲的程度即與α-keratin中半胱胺酸(Cysteine)雙硫鍵排列有關,雙硫鍵排列整齊成為直髮,反之,雙硫鍵排列混亂則為捲髮,故沙龍中燙髮或離子燙等便是利用打斷雙硫鍵和使之重組的原理。

九、參考資料
1.David L. Nelson, Michael M. Cox, 3rd Edition, Lehninger Principles of Biochemistry, p1053-p.1054,p.1061-p.1062。
2.Prescott, Harley, Klein, 4th Edition, Microbiology。
3.Richard A. Goldesby, Thomas J. Kindt, Barbara A. Osborne, 4th Edition, Immunology。
4.The Chinese Chen .SOC, Taipei, June 2000 Vol.50, Chemistry, No.2, pp.309-316。
5.Reginald H. Garrett & Charles M. Grisham, 1999, Biochemistry, 2nd , Saunders College Publishing, p174-p.176。