酵素催化機制:Serine Proteinases
整理:曾鼎元、陳思妤、謝馨誼、李宜達
5.穩定態之酵素動力論(Steady State Enzyme Kinetics)
6.絲胺酸蛋白酶(Serine proteinase)以形成四面體過渡狀態的形式來切胜肽鍵(peptide bonds)
7.絲胺酸蛋白酶(Serine proteinase)之催化作用所需的四個構造特徵
8.趨同演化(Convergent evolution)造成兩個不同的絲胺酸蛋白酶(Serine proteinase)具有相似的催化機制
9.胰凝乳蛋白酶(chymotrypsin)的結構有兩個反向平行(antiparallel)的β-barrel domains
10.活性區(active site)是由兩個domain的環狀區域(loop region)所形成
11.胰凝乳蛋白酶(chymotrypsin)分子是否從基因複製(gene duplication)演化而來?
12.受質專一性口袋(substrate specificity pocket)裡的不同支鏈影響對受質的不同偏好
14.胰蛋白酶(trypsin)之Asp 189-Lys 突變株(mutant)對受質專一性有意想不到的改變
15.絲胺酸蛋白酶(Serine proteinase)“subtilisin” 的結構為α/β 型
16.Subtilisin和chymotrypsin的活性區相似
18.藉由蛋白質工程的方法研究subtilisin過渡狀態之穩定
19.在受質輔助的催化作用(substrate-assisted catalysis)中受質分子提供了催化的基團(catalytic groups)
1946年,Linus Pauling首先將酵素催化的基本原理公式化,即酵素藉著與特定受質(substrate)的過渡狀態(transition state)強烈結合,以增加化學反應的速率。然而,許多年後,人們還是普遍沒察覺酵素對受質的過渡期之高親和力,扮演了決定受質特異性(substrate specificity)和催化速率的重要角色。在過去幾年,位置突變株的動力學研究並結合x-ray結構,使得特定胺基酸在受質特異性和酵素催化反應兩者中的角色,以及提供催化作用本身的能量基礎資訊,有可能被明確地定義出。Pauling原理的完整推論是在發現一突變株後才顯現出來,此突變株的設計是將酵素的催化速率做改變,結果其受質特異性也會跟著改變,反之亦然。
在這個章節我們將使用serine proteinases為例子敘述一些酵素催化的基礎觀點,而這類的酵素可以水解蛋白質的胜肽鍵(peptide bonds)。我們也可以細查在這些特定的例子中,過渡期是如何被穩定的。
Proteinases在大自然中廣泛分佈,執行了各式各樣的功能。病毒基因產生的proteinases可以切其外鞘蛋白的前驅分子;細菌產生許多不同的細胞外蛋白酶(extracellular proteinases)來降解(degrade)周遭的蛋白質;另外,較高等的生物則利用proteinases發揮不同的功能,如食物的消化、切signal peptides、控制血壓和凝血。許多proteinases以domain的形式存在於大的多功能蛋白質中,而其它的則是獨立較小的多肽鏈(polypeptide chains)。在體內,許多proteinases的活性是藉由內生性的蛋白質抑制物與酵素的結合,而阻斷它們。有很多較小的proteinases和與蛋白質抑制物形成的複合物之三度空間結構已經被測定出;這些大量的資料則能推斷出一些結論出來。
所有具有充分特徵的proteinases屬於以下四種家族之一:serine proteinases、cysteine proteinases、aspartic proteinases以及metallo proteinases。這個分類是依據功能上的標準,即指活性區上最顯著的功能基團(functional group)之種類與性質。相同功能家族的成員通常有演化上的關係,但也有例外的。我們以哺乳動物的 chymotrypsin和細菌的 subtilisin(註一)這兩個serine proteinases,做為代表性的例子來說明其中一種導致蛋白質水解的催化機制。在描敘這兩個酵素的結構、作用機制和工程之前,我們必須先定義一些基本的酵素學概念。
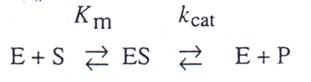
Leonor Michaelis和Maud Menten 早在1913年時提出酵素動力論的基礎,提出的大綱如下:
首先,酵素和受質會先結合形成一個可逆的酵素-受質複合物(ES complex)。化學步驟第二步的發生伴隨一速率常數,稱做Kcat或者是turnover number,這是每單位時間酵素的每個活性位置將受質轉換成產物的最大數量。因此,Kcat是一速率常數,指的是ES複合物的特性和反應。對簡單的反應來說,Kcat即是ES複合物轉變成自由態的酵素和產物此化學轉變的速率常數。
這些定義只有在酵素濃度比受質濃度小很多時才有效。此外,它們只適用於一開始有少部分產物形成時的速率,此時的受質尚未耗盡且產物也未累積到會干擾催化反應的程度。
The Michaelis-Menten scheme漂亮地解釋了為何最大速率(Vmax)總是在受質濃度遠大於酵素濃度時被觀察到(圖1)。當酵素有飽和的受質時,則會得到Vmax;於是便沒有游離的酵素分子可利用來轉變額外的受質。因此,速率便為一常數---Vmax,而且不會再受受質濃度的增加所影響。
當達到最大速率的二分之一(Vmax/2)時之受質濃度稱做Km。在簡單的反應中,Km值約等於ES複合物的解離常數。因此,Km值是敘述酵素對受質的親和力。對更複雜的反應來說,Km則視為是所有酵素結合種類(enzyme-bound species)的總解離常數。
Kcat/Km是一速率常數,與游離的酵素和游離的受質的特性和反應有關。因此,Kcat/Km的ultimate limit由ES複合物一開始形成時之速率常數所決定。此速率不會快於酵素與受質間由擴散所控制的相遇(diffusion-controlled encounter),約每mole每秒108到109。Kcat/Km的量有時稱為specificity constant,因為它敘述酵素對競爭型受質(competing substrates)的專一性。此一數值對突變蛋白的動力學比較很有用。
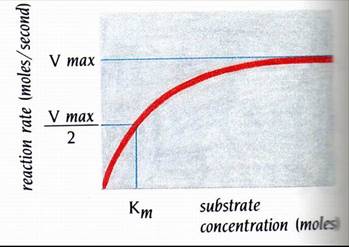
圖1 : 酵素的催化反應,以受質濃度為橫軸,反應速率為縱軸作出的圖形。Vmax為最大速率。Michaelis常數 “Km” 為達到1/2 Vmax時的受質濃度。受質濃度與反應速率的關係可以下式表示:
V=Vmax × [S] / Km + [S] (1)
 Michaelis複合物
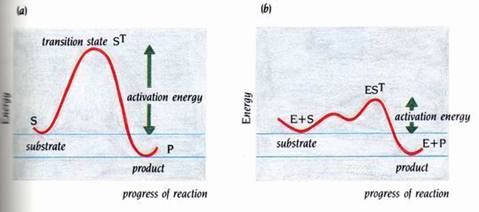
“ES”在產物形成前,經歷了一次或數次過渡狀態的重新排列。這些重新排列需要能量。將游離的酵素和受質變成ES複合物之最高過度狀態所需的能量稱為反應的活化能(圖2)。在缺乏酵素的情況下,受質自發性地轉變成產物的過程,也必須經過過渡的狀態,而此過程也需活化能。藉由酵素的催化作用,可以降低反應的活化能而使速率增加一百萬倍以上,這是因為化學反應的速率完全地依賴其活化能。
Michaelis複合物
“ES”在產物形成前,經歷了一次或數次過渡狀態的重新排列。這些重新排列需要能量。將游離的酵素和受質變成ES複合物之最高過度狀態所需的能量稱為反應的活化能(圖2)。在缺乏酵素的情況下,受質自發性地轉變成產物的過程,也必須經過過渡的狀態,而此過程也需活化能。藉由酵素的催化作用,可以降低反應的活化能而使速率增加一百萬倍以上,這是因為化學反應的速率完全地依賴其活化能。
圖2 : 酵素藉著減少活化能,而加速了化學反應。沒有催化作用的反應(a),比起有酵素催化的相同反應(b),所需的活化能較高。兩個反應的進行都經過過渡時期 “ST”,(a)只有一個過渡時期,而(b)則有兩個不同的過渡時期(1)。
酵素可藉由數種不同的方式達到降低活化能的目的:舉例來說,對特定的反應機制提供有催化能力的基團、藉由與數個其方位適合進行催化反應的受質結合,最重要的一種是,利用受質在過渡狀態與一般狀態時有不同的結合能量。如果酵素與受質之過渡狀態的結合比與受質之正常結構更為緊密,則ES轉變成E+P的活化能將較低(圖3)。酵素對過渡狀態的較高親合力使得在能量上較偏好過渡的狀態,因而減少了活化能。反過來說,如果酵素與受質之過渡狀態的結合比較弱,而形成過渡狀態之結合能量便會降低,因此增加了活化能並使催化作用將不會達成。
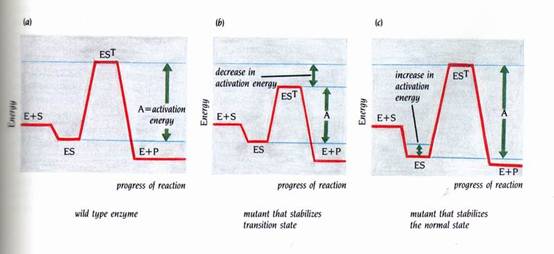
圖3 : 在酵素催化作用中,其中一個最重要的因子是酵素與受質的結合能力在過渡時期要比正常時期緊密。這些時期間結合能量的不同,降低了反應所需的活化能。藉由能量來描繪一酵素,圖(a)是野生型的酵素,圖(b)是突變株,它穩定了過渡狀態(transition state)的受質,因此降低活化能,使ES到EST速率增加;圖(c)是一突變株,它穩定了普通狀態(normal state)的受質,使得速率較低(1)。
既然不同的結合能量與完整的受質分子有關,包括決定受質專一性的基團;很顯然地,專一性和催化速率是相互依賴的。催化作用中不同結合能量的重要性,可以巧妙地藉由最近生產出具有催化活性的抗體產物說明之。此類抗體是由一些小的hapten分子模仿某特定化學反應(例如:ester的水解)的過渡狀態之結構而引發出來的。這些抗體不僅對ester的過渡時期結合得比正常結構來得緊密,並也顯示出重要的催化活性,即使它們在結合位置並沒有任何具有催化能力的residues。
5.穩定態之酵素動力論(Steady State Enzyme Kinetics)
1.我們以一個只具有一個受質的酵素來討論酵素動力論的相關公式,基本的反應方程式如下:
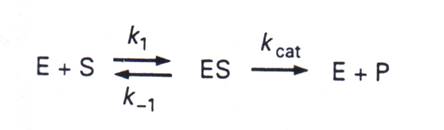
導 Michaelis-Menten公式前的四個基本關係及假設:
(1) 因 [ES] 不變,故 ES 的消耗量等於生成量:
k-1 [ES] + kcat [ES] = k1 [E][S]
(2) 總酵素濃度 [E0] = 單獨存在者 [E] + 酵素受質複合體 [ES]:
[E0] = [E] + [ES]
(3) 反應初速 (vo) 是由後半分解反應 (kcat) 所決定:
vo = kcat [ES]
(4) 最大反應速率 (Vmax) 是假設所有酵素均轉變成 [ES],故上式可改寫為︰
Vmax = kcat [E0] (3)
![]()
反應速率,我們可以下式表示:
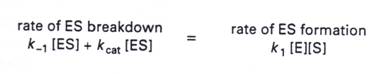
2.當在穩定狀態時 [ES]的量接近一常數,也就是說 [ES]的分解速率等於[ES]的合成速率:
3.全部的酵素[E0]=[E]+[ES],加上上述的方程式,我們可以推得:.
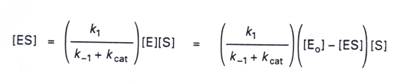
![]()
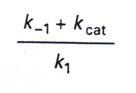
4.接著我們定義
5.將第三點和第四點的式子合併、整理得到:
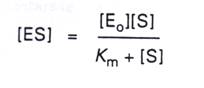
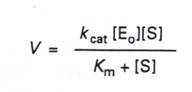
6.再將V=Kcat[ES]代入得:
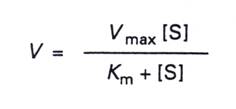
7.當受質增加到很高的程度,而達到穩定的狀態時,所有的酵素都會與受質結合,此時最大速率Vmax=
Kcat[E0],代入上個式子可得到Michaelis-Menten
equation:
8.許多酵素以速率和受質濃度[S]做圖時,所得的飽和曲線並不容易估算Vmax以及Km,所以適當的再整理此方程式,使我們方便求Vmax和Km。將Michaelis-Menten equation倒數化並分解因式可得:
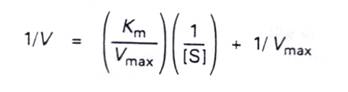
此為一直線方程式 y = a˙x + b
其中 y = 1/v
x=1/[S]
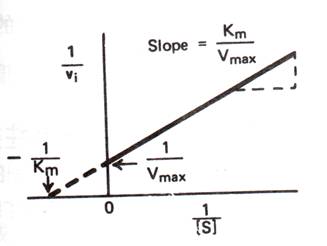
以此方程式作一函數圖:
這樣的圖形稱為雙倒數圖形(double-reciprocal plot)。
6.絲胺酸蛋白酶(Serine proteinase)以形成四面體過渡狀態的形式來切胜肽鍵(peptide bonds)
Serine proteinase會切多胜肽(polypeptide)內的胜肽鍵,以生成兩個新的小胜肽片段(圖4)。此反應經過兩個步驟:第一步是在受質上的C1與酵素的Ser residue上的氫氧基形成共價鍵(圖5a)。在產生acyl-enzyme中間產物之前會經過一帶負電的過渡狀態(圖5a),此處C1的鍵結會形成四面體形而不同於peptide group的平面三角形。在此步驟中,胜肽鍵被切斷,產生的一個小胜肽片段會連接到acyl-enzyme中間產物上,而另一胜肽產物則會快速地擴散離開。反應的第二步(圖5b)--- deacylation:acyl-enzyme中間產物被一水分子水解,釋放出第二個胜肽產物,其末端帶有完整的羰基(-COOH);而酵素上的Ser-hydroxyl也恢復成原本的狀態。此步驟同樣也會經過一帶負電的四面體過渡狀態。
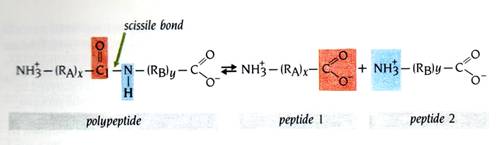
圖4 : 絲胺酸蛋白酶(serine proteinases)催化多肽鏈中的胜肽鍵(peptide bond)水解。被切的鍵稱為可切鍵(scissile bond )。(RA)x和(RB)y代表可變長度的多肽鏈(1)。

圖5 : (a)acyl-enzyme中間產物的形成,牽涉了酵素上具反應性的Ser殘基(reactive Ser residue);此為絲胺酸蛋白酶(serine proteinase)水解胜肽鍵的第一步。胜肽鍵被切的地方形成過渡狀態且C1碳分子與四個基團鍵結形成四面體幾何型,其中包括Ser殘基和帶負電的氧原子。(b)acyl-enzyme中間產物的deacylation是水解的第二步。此步驟實際上即為acylation步驟的反向,水取代多肽受質上NH2基團的角色。酵素蛋白的His殘基在形成四面體過渡狀態時可以接受一個質子(1)。
7.絲胺酸蛋白酶(Serine proteinase)之催化作用所需的四個構造特徵
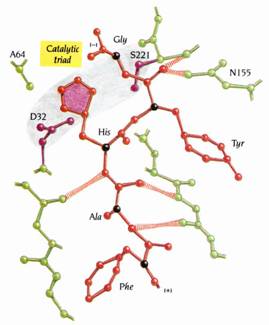
X-ray的研究顯示了Serine Proteinase具有四個不可或缺構造特徵,以促進此催化機制的進行(圖6):
1.提供了一個一般鹼(general base)---His residue,可從具反應性的Ser residue之氫氧基上接受質子,因此促進了共價四面體過渡狀態的形成。His residue是catalytic triad的一部份;而catalytic triad包含三個(Asp、His、Ser)支鏈,三者在活性區域內位置相近,但在多胜肽鏈的胺基酸序列中位置則相隔遙遠。
2.四面體過渡中間產物的緊密結合及穩定,是藉由提供基團與C1上帶有負電的氧原子形成氫鍵而達成。此基團位在酵素的口袋內,稱為oxyanion hole(圖6)。當His residue接受一個質子變成帶正電後,同時也穩定了帶負電的過渡狀態。
3.大多數Serine Proteinase並沒有絕對的受質專一性(substrate specificity)。Serine Proteinase所切的胜肽鍵(scissile bond)其旁邊的支鏈可以有很多種變化。因此多胜肽受質(polypeptide substrate)與酵素間為非專一性的結合,受質以主鏈原子與酵素上一環狀區域的主鏈原子形成氫鍵,而形成短的antiparallel β sheet。其中一氫鍵很長(3.6Å)但在過渡狀態中卻很短。此非專一性鍵結也因此提供了過渡狀態的穩定性。
4.即使這些酵素沒有絕對的專一性,但仍較偏愛切某些支鏈。胰凝乳蛋白酶(chymotrypsin)偏好切芳香族支鏈後的位置,胰蛋白酶(trypsin)偏好切Lys、Arg支鏈後的位置;這些酵素可利用來產生適合的peptides以供胺基酸序列測定及fingerprinting之用。在這些例子中,會偏好於某些支鏈是因為其方向適合於酵素的內袋,稱之為specificity pocket。
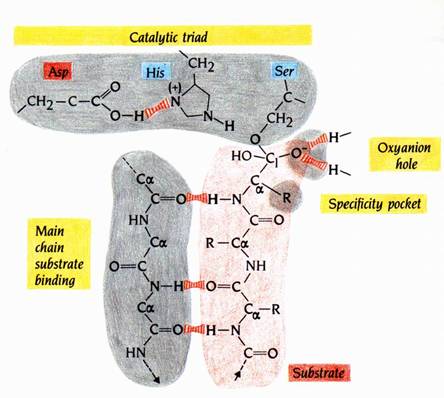
圖6 : 圖示deacylation步驟中四面體過渡中間產物的鍵結模式。絲胺酸蛋白酶四個基本特徵以黃色標出:catalytic triad、 oxyanion hole、specificity pocket和unspecific main-chain substrate binding(1)。
8.趨同演化(Convergent evolution)造成兩個不同的絲胺酸蛋白酶(Serine proteinase)具有相似的催化機制
以上四個特徵在所有chymotrypsin superfamily的成員中幾乎都相同,包含其他胰凝乳蛋白酶(chymotrypsin)、胰蛋白酶(trypsin)、彈性蛋白酶(elastase)、凝血酶(thrombin)。或許我們會天真地以為以上成員有共同的祖先,演化分成不同的絲胺酸蛋白酶(serine proteinases)。然而,枯草桿菌蛋白酶(subtilisin)為一細菌性的serine proteinases,其胺機酸序列及三度空間結構與哺乳動物的serine proteinases有相當大的不同,但卻都有這四個相同的構造特徵。因此,它們來自於不相關的祖先蛋白,卻趨同演化出相同的結構以完成此特定的催化機制。在分子層次上,serine proteinases提供了一個趨同演化的最佳範例,可以詳細比較chymotrypsin和subtilisin的結構。
胰凝乳蛋白酶(chymotrypsin)的結構有兩個反向平行(antiparallel)的β- barrel domains
在1967年,David Blow團隊在劍橋分子生物MRC實驗室測出了chymotrypsin的三度空間結構。此為最先以高解析度瞭解的酵素結構。自此以後,大量serine proteinases的結構,以及與小型胜肽抑制物和大型內生性多胜肽抑制物(endogenous polypeptide inhibitors)所形成的複合物,已被Michael James, Edmonton, Robert Huber, Munich團隊以高解析度測定出來。
Chymotrypsinogen的多肽鏈是chymotrypsin的不活化前驅物,包含245個胺基酸。活化過程中會將Chymotrypsinogen的14-15 和147-148 residues除去。剩下的三條多肽鏈以雙硫鍵鍵結形成活化的chymotrypsin分子。
多肽鏈折疊成兩個domains(圖7),每一部份都包含了120個胺基酸。此兩domains皆形成反向平行(antiparallel)β- barrel形式,每一個包含了六條topology相同的β strands(圖8)。雖然實際的結構看起來很複雜,但topology卻非常簡單:為一個 “Greek key motif ”(strands 1-4)後面接著一個antiparallel hairpin motif(strands 5、6)。
 圖7
胰凝乳蛋白酶的結構圖,折疊成antiparallel
β type的兩個domain。紅色表示每個domain的六條β
strands,藍色為catalytic
triad的支鏈,而紫色則標出連結三條多肽鏈的雙硫鍵。A鏈(綠色,residue
1-13)藉著Cys
1和Cys
122之間的雙硫鍵與B鏈(藍色,residue
16-146)連結在一起。B鏈和C鏈(黃色,residue
149-245)的連結則是靠Cys
136與Cys
201的雙硫鍵鍵結。虛線指出不活化前驅物(chymotrypsinogen)的residue
14-15和147-148。這些residue在chymotrypsinogen轉變成胰凝乳蛋白酶時會被切除(1)。
圖7
胰凝乳蛋白酶的結構圖,折疊成antiparallel
β type的兩個domain。紅色表示每個domain的六條β
strands,藍色為catalytic
triad的支鏈,而紫色則標出連結三條多肽鏈的雙硫鍵。A鏈(綠色,residue
1-13)藉著Cys
1和Cys
122之間的雙硫鍵與B鏈(藍色,residue
16-146)連結在一起。B鏈和C鏈(黃色,residue
149-245)的連結則是靠Cys
136與Cys
201的雙硫鍵鍵結。虛線指出不活化前驅物(chymotrypsinogen)的residue
14-15和147-148。這些residue在chymotrypsinogen轉變成胰凝乳蛋白酶時會被切除(1)。

圖8 胰凝乳蛋白酶(chymotypsin)的domain structure之拓撲圖形。多肽鏈摺疊成一個“Greek key motif”後面再接著 “hairpin motif”,排列成六個stranded antiparallel β barrel(1)。
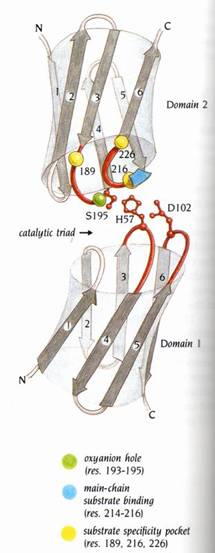
9.活性區(active site)是由兩個domain的環狀區域(loop region)所形成
活性區位於兩個domain之間的裂縫。Domain 1包含catalytic triad的兩個residue---His 57及Asp 102;Domain 2則包含catalytic triad的reactive Ser 195(圖7)。
抑制劑(inhibitors)和受質(substrates)會結合到domains之間的這個裂縫。以小的胜肽抑制劑-Ac-Pro-Ala-Pro-Tyr-COOH結合到細菌胰凝乳蛋白酶(chymotrypsin)為例(圖9):加入過量的受質-Ac-Pro-Ala-Pro-Tyr-CO-NH2到酵素的晶體(crystals),形成酵素-胜肽複合物(enzyme-peptide complex)。晶體裡的酵素分子會催化切除末端醯胺基(amide group)的反應,生成Ac-Pro-Ala-Pro-Tyr-COOH及NH3+。NH3+擴散離開,但胜肽產物仍以抑制劑之姿結合到酵素的活性區。
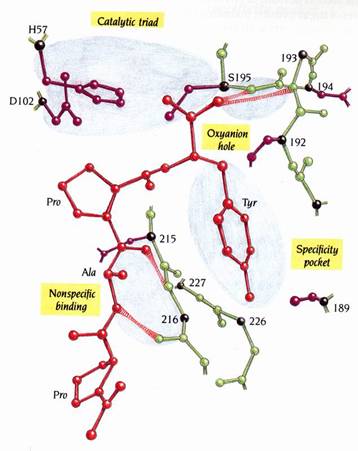
圖9
:
圖中所顯示的為胰凝乳蛋白酶(chymotrypsin)的活性區,其上結合了一抑制劑(Ac-Pro-Ala-Pro-Tyr-COOH)。此圖說明了抑制劑如何和catalytic
triad、受質專一性口袋(the
substrate specificity pocket)、oxyanion
hole和非專一性受質結合區(nonspecific
substrate binding region)產生結合。紅色部分為抑制劑,抑制劑和酵素之間的氫鍵則以斑紋表示(1)。
抑制劑並不會和Ser 195形成共價鍵,但是其中一個羰基氧原子(carboxyl oxygen atom)會在oxyanion hole和主鏈上residue193及195的-NH形成氫鍵。tyrosyl side chain位於專一性口袋,其專一性主要來自三個residue-216,226,及189。抑制劑的主鏈和酵素上的residue215-216以形成一段反向平行β摺板(antiparallel βsheet)來和residue 215的-NH及residue 216的-CO形成氫鍵。
 這些包含catalytic
triad在內的essential
residues皆為兩個domain裡相同的兩個loop
regions(3-4及5-6)的一部分(圖10)。Domains在分子內的方位為:兩個barrel的一端,在β
strands 3和4之間形成Greek
key crossover connection,沿著活性區彼此相對。活性區位的essential
residues,位於這兩個crossover
connection以及β
strands 5和6之間形成的hairpin
loops上。在chymotrypsin
superfamily的不同成員中,大部分的essential
residue為保守(conserved)的。而其周圍則有多胜肽鏈的其他部分,提供活性區做些微的調整,這些調整依每一個別的serine
proteinase而所不同。
這些包含catalytic
triad在內的essential
residues皆為兩個domain裡相同的兩個loop
regions(3-4及5-6)的一部分(圖10)。Domains在分子內的方位為:兩個barrel的一端,在β
strands 3和4之間形成Greek
key crossover connection,沿著活性區彼此相對。活性區位的essential
residues,位於這兩個crossover
connection以及β
strands 5和6之間形成的hairpin
loops上。在chymotrypsin
superfamily的不同成員中,大部分的essential
residue為保守(conserved)的。而其周圍則有多胜肽鏈的其他部分,提供活性區做些微的調整,這些調整依每一個別的serine
proteinase而所不同。
圖10 : 胰凝乳蛋白酶(chymotypsin)的兩個domain之拓撲圖形。說明了活性區的必要殘基皆為兩個domains之兩個相同loop regions(3-4和5-6)的一部分。這些residue形成catalytic triad(紅色)、oxyanion hole(綠色),以及包含專一性口袋裡的必須residue在內的受質結合區(黃色及藍色)(1)。
His 57和Ser195分別位於domain1和domain 2的loop3-4內。catalytic triad的第三個residue,Asp 102,則位於domain1的loop5-6內。活性區的其他部分則是由domain2的兩個loop regions(3-4和5-6)所形成。
10.胰凝乳蛋白酶(chymotrypsin)分子是否從基因複製(gene duplication)演化而來?
雖然胰凝乳蛋白酶(chymotrypsin)的兩個domains具有相似的三度空間結構,但它們之間的胺基酸序列並沒有同源性。以三度空間結構較胺基酸序列保守的論點為基礎,chymotrypsin superfamily的成員是由單一的祖先蛋白酶區域(ancestral proteinase domain)的基因複製演化而來。推想的 “ancestral domain”想當然爾並沒有現今絲胺酸蛋白酶(serine proteinases)的catalytic triad,因為triad是由兩個domains而來。ancestral domain具有類似胰凝乳蛋白酶domain 2的barrel構造,包含了活性區大部分的重要特徵,具反應性的serine residue也包括在內。從一些以遺傳工程實驗將triad被廢除的突變種中,我們發現catalytic triad對催化活性並非絕對必要。這些突變種仍保有部分的蛋白酶活性。因此,很有可能是對應單一domain的一個單一祖先基因具有某些催化活性。基因複製增加了此一活性,然後經過突變而演化成今天的catalytic triad。chymotrypsin活性區的residue包含了catalytic triad及其相關物聚集在domain1和2的兩個相同loop regions,支持了這個演化論點。
11.受質專一性口袋(substrate specificity pocket)裡的不同支鏈影響對受質的不同偏好
一個家族中不同的成員會偏好在受質裡鄰近不同胺基酸residue的位置切多肽鏈。以chymotrypsin
superfamily的3個成員為例-胰凝乳蛋白酶(chymotrypsin),胰蛋白酶(trypsin),及彈性蛋白酶(elastase),它們的三度空間結構相似但專一性卻不相同。chymotrypsin偏好切含有大量芳香族殘基的支鏈,trypsin偏好切帶正電的支鏈,elastase則偏好切小的不帶電支鏈。殘基(residue)189,216,226為造成此偏好的三個主要殘基。殘基216,226位於口袋的兩側-在chymotrypsin和trypsin中這兩個殘基皆為甘胺酸(glycine),能讓受質的支鏈穿過專一性口袋的內部。在elastase則分別為擷胺酸(valine)及酥胺酸(threonine),使疏水性基團幾乎充滿了整個口袋,故偏好小的不帶電支鏈(圖
 11)。
11)。
圖11 : chymotrypsin、trypsin和elastase的專一性口袋。說明它們對多胜肽受質中被切的鍵結(scissile bond)之鄰近支鏈的偏好。Chymotrypsin偏好芳香族的支鏈,trypsin偏好帶正電的支鏈(可與專一性口袋底部的Asp 189作用),而elastase則偏好小的不帶電支鏈(1)。
殘基189位於專一性口袋的底部,在trypsin這個位置上為天門冬酸(Asp)殘基,會和受質中帶正電的Lys或Arg支鏈作用。在chymotrypsin則為Ser殘基,此不會干擾與受質的結合作用。因此在此疏水性的專一性口袋裡,chymotrypsin較偏好大型的芳香族支鏈。
如果將胰蛋白酶(trypsin)位於殘基216及226的glycine換成alanine,受質的偏好會發生什麼改變?Charles Craik、William Rutter,和Robert Fletterrick研究了三個胰蛋白酶突變種(trypsin mutants):一個是Ala取代殘基(residue)216的Gly,一個是Ala取代殘基226的Gly,第三個是兩個位置的Gly都被Ala取代。
這個實驗建立的模型顯示,在Gly被Ala取代後,含有Arg、Lys的受質仍能被受質專一性口袋所容納,但在口袋底部的結合模式有某些細節則被改變。只有殘基226被Ala取代的酵素,在支鏈結合處的末端會加上一個甲基團(methyl group)(圖12),因此Lys的容納度會優於Arg,因為後者含有較長也較多的支鏈。單就空間上的論點而言,含有Arg的受質Km值較高(結合能力較差),含有Lys的受質Km值則沒改變。至於專一性常數(specificity constant),Kcat/Km,在含有Arg的受質則會較含有Lys的受質減少更多。
Ala 216突變種會將專一性口袋底部的水分子取代掉,而此水分子在野生種中會與受質Lys支鏈的NH3+做結合(圖12)。而此額外的甲基對Arg支鏈的結合並不會造成妨礙。因此,Lys受質的Km值會增加,而Kcat/Km在含有Lys的受質則會較含有Arg的受質減少更多。至於Gly216及226皆突變的突變種,不論是含Lys或是含Arg的受質兩者的Km值都會增加。
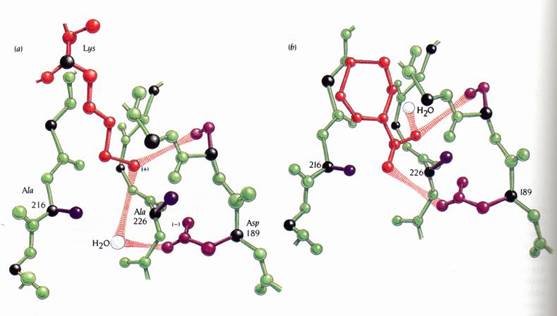
圖12
:
將胰蛋白酶(trypsin)216和226位置的Gly突變成Ala(紫色)的突變株之專一性口袋。(1)
Table 1為野生種及突變種的動力學結果。Arg受質的3個突變種其Km值都約為野生種的15-35倍,但Kcat則減少10-1000倍。突變種被設計來改變專一性,但結果改變最大的卻是催化速率。這些突變顯然地藉由別種方式影響了酵素的結構,可能是造成專一性口袋外面的構形改變,而降低了過渡狀態(transition state)的穩定性,因此造成了反應的活化能不同。比較Arg受質和Ala受質的專一性常數(specificity constant,Kcat/Km)之比率(Table 1的最後一欄),可以量測相對的專一性(relative specificities)。Ala 226突變種的比率降低,而Ala 216突變種的比率增加。然而,這些數值的改變不只是因為Km值(反映受質的結合力)的改變,更因為Kcat值(反應催化速率)的改變。
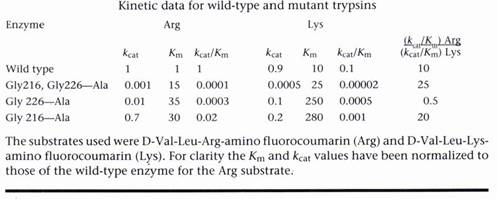
Table.1
13.胰蛋白酶(trypsin)之Asp 189-Lys 突變株(mutant)對受質專一性有意想不到的改變
在受質專一性口袋(substrate specificity pocket)底部的Asp 189會和受質中的Lys和Arg 支鏈發生交互作用,而這就是trypsin所切的位置有此偏好的根據(圖11、12)。
有些突變實驗的結果令人十分驚訝。 “Asp 189-Lys mutant” 完全不會與Asp和Glu 受質產生反應,與 Lys和Arg 受質也不會產生反應。然而此mutant卻能催化Phe和Tyr受質,且與野生型的胰蛋白酶(wild-type trypsin)一樣有低的turnover number。雖然此mutant的三度空間結構尚未被測定出來,但是對於其動力學的行為有一個可能的解釋,就是Lys 189支鏈的尖端會遠離受質專一性口袋的方向,以防止帶正電荷的基團跑進疏水性口袋內。
14.絲胺酸蛋白酶(Serine proteinase)“subtilisin” 的結構為α/β 型
Subtilisins 是serine proteinases中的一類,由不同種的桿菌所產生。而這些酵素添加到清潔劑裡面,會促進蛋白質污漬的去除。因此最近欲利用蛋白質工程的方法改變subtilisins分子的某些特性,例如對熱的穩定性、最理想的pH值以及專一性。
Subtilisins是由275個胺基酸所組成的一條多肽鏈,且和chymotrypsin的胺基酸序列沒什麼相似處。subtilisins結構的主要特徵是由四條helices環繞著由五個平行β strands所構成的一個區域(圖13的藍色部分)。此α/β的結構和chymotrypsin的兩個反向平行的β-barrel結構(double antiparallel β-barrel structure)非常不同(圖7)。
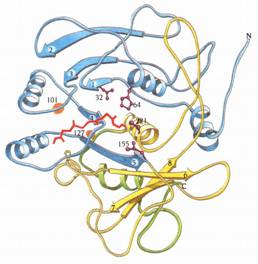
圖13 : subtilisin的三度空間結構,從中央的parallel β sheet往下看。N端的區域包含有α/β structure,以藍色表示。其後接著黃色的區域。C端的部分則以綠色表示。Catalytic triad---Asp 32、His 64、Ser 221以及Asn 155(形成oxyanion hole的一部分)則以紫色表示。紅色表示一部分多肽鏈抑制劑的主鏈。Subtilisin主鏈上約residue 101和127的位置(橘色圈圈),形成多胜肽受質的非專一性結合區(1)。
15.Subtilisin和chymotrypsin的活性區相似
Subtilisin的活性區位於central β strands的羧基端(carboxy ends)外側,和其他α/β蛋白質的結合位(binding site)的位置類似。此活性區的細節與chymotypsin的十分相似,儘管兩酵素的摺疊是完全的不同。然而catalytic triad是由residues Asp 32,His 64和具反應性的Ser 221所組成。四面體形過渡狀態的帶負電氧原子會結合到oxyanion hole,而oxyanion hole中的Asn 155支鏈之amide group會提供氫鍵和Ser 221主鏈上的氮原子鍵結。而胜肽受質(peptide substrates)和抑制劑會藉由形成小的反平行摺板(antiparallel pleated sheet)而與subtilisin做非專一性地結合(圖14)。
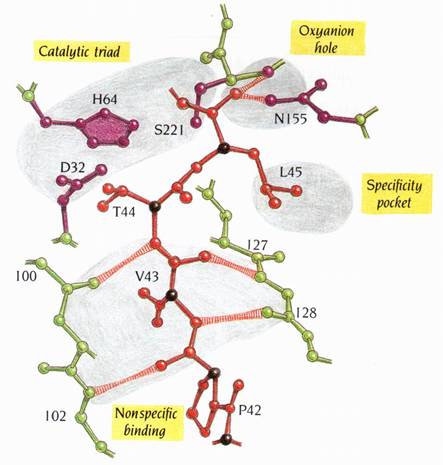
圖14
:
圖為subtilisin的活性區,並有一個多胜肽抑制劑eglin結合到此活性區上。圖上所顯示的只有抑制劑residue
42-45的區域,以紅色表示。活性區四個必要的特徵為:catalytic
triad、oxyanion
hole、專一性口袋(specificity
pocket)和受質的非專一性結合區。酵素與抑制劑間重要的氫鍵以條紋表示。此圖可與圖9相互比較(1)。
subtilisin的結構有一異常且令人迷惑的特徵。所有的β-α-β motifs(註二)都是右手旋(right-handed)的,但subtilisin包含了一個例外,其topology的圖示見圖15。subtilisin中有三個β-α-β motifs,分別是β2-αB-β3,β3-αC-β4和β4-αD-β5。要是這些motifs都一樣是右手旋的話,那麼αB、αC和αD都將會在β sheet的同一邊。然而,αB會因為β2-αB-β3為左手旋(left-handed)而與其他兩個helices位於sheet的不同側。為什麼會演化出這種異於一般規則的左手旋β-α-β motifs?答案相當清楚,即是因為His 64是catalytic triad的一部分,位於helix αB的第一個turn(圖13)。如果β2-αB-β3為右手旋的話,這個helix就會位於β sheet的另一邊,並且遠離活性區的部分。所以為了讓Asp32、His64和Ser221能產生一個適當的catalytic triad,β2-αB-β3必須與Ser221在β sheet的同一側,因此變演化出左手旋的β-α-β motif。
17.藉由蛋白質工程的方法研究subtilisin過渡狀態之穩定
serine proteinases中有兩個必要的特徵,用來穩定共價四面體形的過渡狀態(covalent tetrahedral transition state),一個是oxyanion hole,可以提供氫鍵給過渡狀態中帶負電荷的氧原子;第二個為catalytic triad的histidine residue,會提供正電荷。而histidine的正電荷則由catalytic triad的Asp支鏈所穩定(圖6)。而histidine residue在催化機制中所扮演的角色是從具反應性的Ser residue接收一個質子,然後再將之傳給要離開的基團(leaving group)之氮原子。Catalytic triad和oxyanion hole中不同的支鏈對催化速率的影響,由美國的P. Carter、J.A. Wells和D. Estell,經由對subtilisin的突變株做分析、研究而得。
18.催化作用在沒有catalytic triad的情形下即可發生
將subtilisin的Ser 221改變成Ala,則反應速率(Km和 Kcat/Km)會比野生型的酵素(wild-type enzyme)約降低106倍。推論上,在受質一開始結合時的Km值並沒改變。此突變會防止酵素與受質間共價鍵的形成,因此會廢止反應的機制(圖5)。當Ser 221變成Ala的突變株,再有His 64變成Ala或Asp 32變成Ala,或是兩者都發生的話,這樣對於催化的反應速率也不會有更進一步的影響,這是因為由catalytic triad所參與的反應機制已不再運作。然而,此酵素仍然有些催化的效果,其對胜肽的水解速率會是沒有酵素時的103-104 倍。不管這些突變株所利用的反應機制為何,它們很顯然地還保有部分的活性區,能與受質的過渡狀態結合得比與最初狀態結合得還緊,因此反應速率會比沒酵素時還快。
19.在受質輔助的催化作用(substrate-assisted catalysis)中受質分子提供了催化的基團(catalytic groups)
subtilisin在His 64-Ala的單一突變,會使其對大部分受質的反應速率降低,而降低的倍數(約106)與Ser 221的突變株一樣。因此His 64似乎和Ser 221一樣,都對共價四面體形中間產物(covalent tetrahedral intermediate)的形成很重要。然而,model building與實驗的結果顯示:當His 64突變成Ala時,也就是His 64被Ala取代,會使整個反應速率變慢,但要是跟mutant enzyme作用的受質在序列上的適當位置有His的話,就可以補償mutant protein中失去的His,而使反應速率變快約400倍(圖16)。而此速率仍較野生型的酵素(wild-type enzyme)慢好幾倍,可能的原因是His支鏈的位置和方位仍有些微的不同。
 Asp
32-Ala的突變株會降低催化的反應速率,比野生型約慢104倍。此速率的降低反映出Asp
32能穩定His
64於過渡狀態時所取得的正電荷。而Asn
155-Thr突變株也同樣會使反應速率降低。Asn
155的角色是於subtilisin的oxyanion
hole的位置,提供給受質過渡狀態一個氫鍵的穩定力量。Model
building顯示:如果將Asn
155突變成Thr的話,其OH
group會距離太遠而無法提供這樣的氫鍵。當失去此一穩定過渡狀態的特徵後,反應的速率便會降低1000倍以上。
Asp
32-Ala的突變株會降低催化的反應速率,比野生型約慢104倍。此速率的降低反映出Asp
32能穩定His
64於過渡狀態時所取得的正電荷。而Asn
155-Thr突變株也同樣會使反應速率降低。Asn
155的角色是於subtilisin的oxyanion
hole的位置,提供給受質過渡狀態一個氫鍵的穩定力量。Model
building顯示:如果將Asn
155突變成Thr的話,其OH
group會距離太遠而無法提供這樣的氫鍵。當失去此一穩定過渡狀態的特徵後,反應的速率便會降低1000倍以上。
圖16 : 受質輔助的催化作用(substrate-assisted catalysis)。圖上所顯示的為受質NH2-Phe-Ala-His-Tyr-Gly-COOH(紅色)與subtilisin His 64-Ala突變株的結合情形。說明了受質上的His residue大體上能佔據原本subtilisin的His 64所應存在的位置,因此能恢復部分catalytic triad的功能(1)。
20.結論
酵素藉由降低活化能來增加化學反應的速率,主要是靠與受質的過渡狀態有較強的結合力來達成。酵素的催化基團可達成特定的反應路徑使受質轉變成產物。
絲胺酸蛋白酶(serine proteinases)例如胰凝乳蛋白酶(chymotrypsin)和枯草桿菌蛋白酶(subtilisin)可催化胜肽鍵的裂解。四個催化的必要特徵表現於所有絲胺酸蛋白酶的三度空間結構:catalytic triad、oxyanion binding site(即oxyanion hole)、受質專一性口袋(substrate specificity pocket)和多胜肽受質的非專一性結合區(nonspecific binding site)。這四個結構上的特徵在胰凝乳蛋白酶(chymotrypsin)和枯草桿菌蛋白酶(subtilisin)中有非常相似的排列方式,即使它們的三度空間結構差異很大,並以完全不同的方式達成。Chymotrypsin由兩個β- barrel domains構成,而subtilisin的結構則是α/β型。此兩酵素提供了趨同演化的例子,兩者擁有完全不同的loop regions,附著到不同的骨架(framework)結構,但卻有相似的活性區。
Catalytic triad包含Asp、His和Ser的支鏈,而且彼此間很接近。Ser殘基(residue)具有反應性(reactive),並與受質形成共價鍵,由此提供了反應的特定路徑。His有兩個角色:第一個是從Ser接受一個質子,以促進共價鍵的形成;第二個則是穩定帶負電的過渡狀態。質子隨後便轉移給leaving group的氮原子。Ser和His兩個殘基的突變,降低了催化速率約106倍,因為它們廢止(abolish)了專一的反應路徑。Asp藉著穩定His的正電荷,以幫助反應速率的增加,約104倍。
Oxyanion binding site藉由與受質上帶負電的氧原子形成兩個氫鍵,以穩定過渡狀態。枯草桿菌蛋白酶(subtilisin)若因突變而使其中一個鍵結無法形成,則反應速率將會降低約103倍。
胰蛋白酶(typsin)之專一性口袋(specificity pocket)的突變,是設計來改變酵素對受質的偏好性,但結果也對催化速率造成了激烈的影響。這些突變株證明了酵素的受質專一性和催化速率的增強效果間有很緊密的關聯性,因為兩者都受到酵素與過渡狀態以及與一般狀態之間有不同的結合強度所影響。
21.附註:
一、Subtilisin : 它屬於一種鹼性的蛋白酶,由枯草桿菌屬(genus Bacillus)的成員所分泌。它是serine proteases,且會被diisopropyl fluorophosphate所抑制,當它加入清潔劑裡面,會促進蛋白質污漬的去除。Subtilisin會對proteinaceous substrates表現出高專一性之活性。而且它能藉由和鈣(calcium)鍵結而獲得穩定。Subtilisim BPN'是一種由275個胺基酸構成的單體蛋白(monomeric protein),而鈣是野生型的摺疊結構中不可或缺的一個部分(2)。
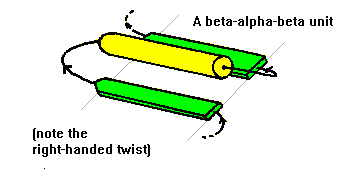
二、β-α-β motifs : 反向平行的(antiparallel)β strands可以藉由短的多胜肽相連接,形成β-hairpin的結構。而平行的(parallel)β strands則靠較長的多肽鏈所連接,此較長的鏈會橫越β sheet,而且常常包含一α helix的部份。此motif稱為α-β-α motif,幾乎皆為右手旋(right-handed)的形式,能在大多數具有parallel β sheet之蛋白質中被發現(4)。
三、胰凝乳蛋白酶(chymotripsin)的蛋白質水解作用
雖然胃蛋白酶(pepsin)在胃中分解蛋白質分子,但大多數的蛋白質分解作用發生於食物離開胃進入小腸的時候。此處的酵素,例如:胰蛋白酶(trypsin)、胰凝乳蛋白酶(chymotripsin)、彈性蛋白酶(elastase)、carboxypeptidase及aminopeptidase,它們會將蛋白質分解成胺基酸、雙胜肽(dipeptide)和三胜肽(tripeptide)。而雙胜肽和三胜肽,則再由其他的酵素將之轉變成胺基酸。一旦胺基酸游離,即可進入血液,循環全身。
在所有消化的形式中(蛋白質、碳水化合物、脂質),大分子分解成小分子
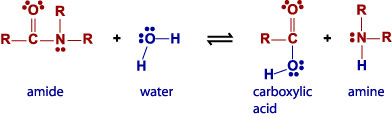
的反應會有水的參與;水分子會被切成兩部分,每一部分各與一不同的產物分子結合,稱之為水解。蛋白質分解成胺基酸時將會有一連串的水解。
RCONR2 +H2O ó RCO2H +HNR2
以上的反應實際上很慢,但酵素的幫助可以催化反應,加速反應時間。在enzyme-mediated reaction中,作用的分子稱為受質(substrate),必須能與酵素的活性區(active site)相吻合。每種酵素只能與某些特定的分子作用,如胰蛋白酶(typsin)加速切斷無極性支鏈胺基酸的胜肽鍵。
以下為Chymotrypsin的水解機制:
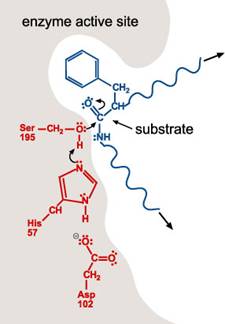 1.
一多肽受質進入酵素的活性區。Chymotrypsin活性區的形狀、大小、和胺基酸序列,能讓具有非極性支鏈的多胜肽結合到酵素上。一旦多胜肽進入活性區,酵素上Ser-195的H+
就會移動到His-57上。Serine氫氧基團的氧原子與受質的一個胜肽鍵形成共價鍵,使一雙鍵轉變成一單鍵及兩個電子(lone
pair)。
1.
一多肽受質進入酵素的活性區。Chymotrypsin活性區的形狀、大小、和胺基酸序列,能讓具有非極性支鏈的多胜肽結合到酵素上。一旦多胜肽進入活性區,酵素上Ser-195的H+
就會移動到His-57上。Serine氫氧基團的氧原子與受質的一個胜肽鍵形成共價鍵,使一雙鍵轉變成一單鍵及兩個電子(lone
pair)。
2. 帶負電的Asp-102穩定了His-57的正電荷。當胜肽鍵中碳和氧的雙鍵再次形成,則碳及氮的鍵結斷裂。含氮基團為求穩定會與His-57的氫原子鍵結。
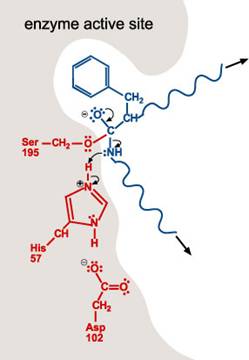
3. 包含氮原子(自胜肽鍵的斷裂而得)的多胜肽會離開活性區。
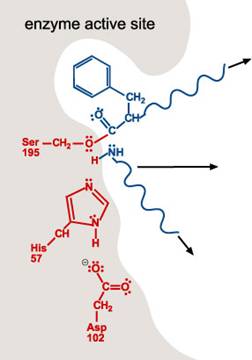
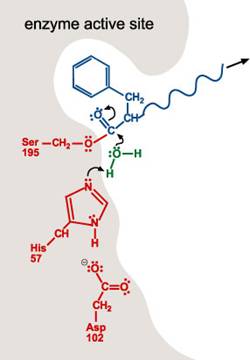
4. 一個水分子進入活性區。水分子上的氧丟一個H+給His 57的氮原子。這也使得水分子的氧原子可與受質的碳結合。如第一步驟,雙鍵中的一個單鍵變成lone pair。
5. 當雙鍵再次形成,碳與Ser-195的氧原子之間的鍵結斷裂。His-57提供H+使Ser-195的H group再次形成。在此步驟,Ser-195 和His-57恢復了其原始結構。
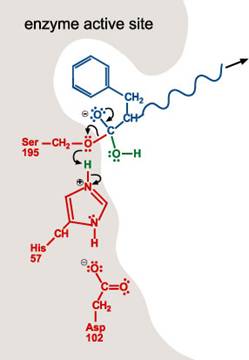
6. 剩下的受質移出活性區。活性區楚於原始的狀態,可對其他多肽分子重複1~5步驟。
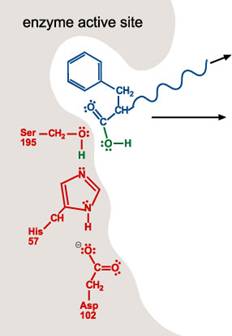
22.參考資料
1. Branden, C., Tooze, J. 1991. Introduction to protein structure, p.231-p.246, 1st ed. Garland Publishing, Inc., New York.
2. http://www.carb.nist.gov/gilliland_group/molecules/subtilisin.html
3. http://140.112.78.220/~juang/BCbasics/Enzyme34.htm
4. http://www.cryst.bbk.ac.uk/PPS2/course/section9/sss/super5.html