蛋白質定量法
I.UV 吸光法(Utraviolet Absorption Method)
這個部份我們以Bradford protein–binding assay實驗,來說明如何定量蛋白質。
以Bradford protein–binding assay 的方法進行蛋白質定量,此定量方法利用Coomassie Brilliant Blue G-250會與蛋白質結合的特性,在G-250與蛋白質結合後,G-250的顏色會從紅色轉變成為藍色,此時在595 nm波長下,會有較高的吸收,以便偵測。這個方法的優點為G-250與蛋白質結合所需的時間很短(大約2分鐘左右),且結合的G-250-蛋白質複合物(complex)可在溶液中維持較長的時間(大約1小時)。此法方便而靈敏(10 ng 左右),且可使用微量滴定盤進行分析,可減低試劑用量,方便大量樣本的操作。
10 mM citric acid-sodium citrate buffer, pH 5 (10 mM citric acid及10 mM sodium citrate)
Bovine serum albumin (BSA, Sigma A2153): standard protein solution, 100 mg/ml
Bio-Rad Dye Reagent (Bio-Rad, 500-0006): 1/4 dilution water
Microtiter plate (Nunc, 442404)
Micro test tubes, pin or torch flame
1. 備製BSA標準溶液,並混合均勻
|
Label |
0 |
1 |
2 |
3 |
4 |
5 |
|
BSA (100 mg/ml) (ml) |
0 |
100 |
200 |
300 |
400 |
500 |
|
Citrate buffer(10mM) (ml) |
500 |
400 |
300 |
200 |
100 |
0 |
|
總體積(ml) |
500 |
500 |
500 |
500 |
500 |
500 |
|
最終濃度(mg/ml) |
0 |
20 |
40 |
60 |
80 |
100 |
2. 備製樣本溶液:
(1) Blank :500 ml 10 mM citric acid-sodium citrate buffer
(2) 原酵素抽取溶液: 500 ml 抽取的酵素溶液
(3) 1/2倍稀釋之酵素抽取溶液:取250 ml 抽取的酵素溶液加入250 ml 10 mM citric acid-sodium citrate buffer,混合均勻。
3. 各取50 ml 備製好的標準溶液及樣本溶液加入ELISA plate 中,並重複二次。
4. 每個well 中加入
(1)200 ml diluted Bio-Rad Dye Reagent Diluted Regagent 的配置:
以4倍的去離子水加1倍 Bio-Rad Dye Reagent稀釋,並混合均勻,
此稀釋液可在室溫下使用2星期。
(2)15 ml undiluted Bio-Rad Dye Reagent.
所使用 Dye Reagent的濃度及用量視抽取樣本中的蛋白質濃度而
定,標本濃度高用(1) ,而濃度低用(2) ,Reagent 加入後溫和地輕
敲plate邊緣。注意:避免氣泡產生。
5. 於室溫下靜置10 分鐘後,標準溶液以label 0 作為blank,樣本溶液以B作為blank,於ELISA reader 測595 nm吸光值。
6. 紀錄ELISA reader 測得的595 nm吸光值。並依據BSA標準濃度及其吸光值繪製標準曲線圖。
|
|
BSA標準溶液(mg/ml) |
樣本溶液 |
|||||||
|
|
0 |
20 |
40 |
60 |
80 |
100 |
B |
1 x |
1/2 x |
|
數據1 |
|
|
|
|
|
|
|
|
|
|
數據2 |
|
|
|
|
|
|
|
|
|
7. 依據BSA標準濃度及其吸光值繪製標準曲線圖。
8. 依據標準曲線圖估計樣品之蛋白質濃度(mg/ml)。
- 目前所使用試劑可直接向業者購買,再依業者提供的使用步驟進行。若要自行配製試劑,可以下列步驟進行蛋白質定量:
(1)取2 ml待測之樣品,加水至500 ml。
(2)加入500 ml蛋白質分析反應劑(protein assay reagent),混合均勻。
(4) 靜置5分鐘後,測其595 nm波長之吸光值。(Blank 為取2 ml緩衝液,加水至500 ml,加入500 ml蛋白質分析反應劑)。
材料:
1.蛋白質分析反應劑:0.01%(w/v) Coomassie Brilliant Blue G-250,4.7% (w/v) ethanol及 8.5%(w/v) phosphoric acid。
- 蛋白質定量的方法除利用Bradford protein-binding assay之外,還有其他定量方法:
I. UV 吸光法(Utraviolet Absorption Method)
一般有機物質,對於波長在250 nm 以下的光才有吸收作用,但含有苯環的胺基酸(aromatic amino acids),對於波長250 nm 以上的光卻有吸收作用。
|
aromatic amino acids |
最大吸光波長 |
|
Phenylalanine |
260 nm |
|
Tyrosine |
275 nm |
|
Tryptophan |
280 nm |
凡含有此等胺基酸的蛋白質,其水溶液對於波長在260 nm至290 nm (通常取280 nm波長)之光,均有吸收作用,其吸收量與蛋白質溶液的濃度成正比。所以含有phenylalanine、tyrosine或tryptophan的蛋白質,均可採用此法來定量。不過,本法易受對於280 nm附近的光也有吸收作用的其他化學物質的干擾。核酸對於260 nm的光有很大的吸收作用,而對280 nm 的光吸收作用僅及前者1/10,在生物體中,蛋白質常與核酸結合在一起,故蛋白質之定量宜作下列修正:蛋白質溶液概約濃度(mg/ml) = 1.45 A280 – 0.74 A260。胺基酸的aromatic group在280 nm 有吸光,蛋白質peptide bond骨架上的基團在200 nm 附近有吸光。由於各種蛋白質所含aromatic amino acids組成不一,它們在280 nm 的吸光值能力亦不同。
Biuret試劑乃鹼性硫酸銅溶液,銅離子在鹼性溶液中,會與蛋白質上的peptide bonds結合,生成藍色或紫色的複合物(Biuret, NH2CONHCONH2),由於biuret是在鹼性環境中和CuSO4發生呈色反應之最小單位,故此反應稱biuret試驗。其反應式如下:
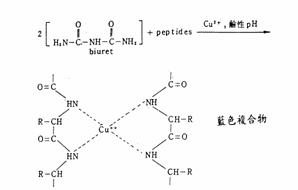
Biuret方法的靈敏度(sensitivity)較差(10 mg 左右),會受樣品中某些化合物所干擾,例如:硫酸銨、Tris、Ammonia及Glycerol,若是修正一些實驗步驟來排除這些干擾,通常會花費較多的時間且實驗步驟會變得較複雜。Biured 方法準確度較高,不受蛋白質的種類影響。其顏色的深淺與peptide bonds的數目成正比,故由之可決定蛋白質的量。一般言之,蛋白質分子越小,經此反應後所呈之色越粉紅,故反應後,分子量較小的蛋白peptone呈粉紅色,而分子量較大的卵蛋白(albumin) 則呈藍紫色。
本反應只對含有三個或三個以上peptide bonds的蛋白質有反應,而對只含有一個peptide bond的雙胜鈦(dipeptide)及不含peptide bond的氨基酸(serine及threonine除外),則無此反應。
是Biuret法的延伸。銅離子在鹼性溶液中,與peptide bonds形成複合物後,可進一步的將Folin reagent 內的phosphomolybdic-phospho- tungstate 還原而使溶液變為藍色,在波長660 nm有很強的吸光,故測定OD660,並與已知濃度之蛋白質比較,換算出待測液中蛋白質含量。由於本法所呈現的顏色較Biuret 方法為深,因此靈敏度較Biuret方法為佳(可測至約0.1 mg),本方法也會受硫酸銨、鉀離子、鎂離子、EDTA、Tris、硫醇化合物(thiol reagent)以及碳水化合物的干擾。
蛋白質在溶液中,和Folin reagent所生之呈色反應,可分為兩個階段:
1. 加入alkaline copper reagent (2% Na2CO3, 0.1 N NaOH, 0.01% CuSO4.5H2O, 0.02% sodium potassium taratrate),蛋白質溶液先在鹼性溶液中,先和銅離子發生反應:
Cu2+ + Protein- ↔ Cu – Protein
此段反應可能與Biuret反應相似。Lowery 及其共同研究者,曾求得第一階段的視解離常數(Apparent dissociation constant)
Kapp = [Cu2+][Protein-]/[ Cu – Protein]
在[Cu2+] 低時K = 3´10-6 mole/L
2. 然後加入Folin reagent (為酸性溶液,含有10% (g/v) sodium tungstate (Na2WO4.2H2O), 2.5% (g/v) sodium molybdate (Na2MoO4. 2H2O,由 4.3% phosphoric acid),蛋白質內含有苯環的胺基酸(aromatic amino acids)在銅離子的催化下,可將Folin reagent中的phosphomolybdic-phospho-tungstic acid還原成heterpolymoly- bdenum blue,進一步使得溶液的顏色變為較深的藍色。
此試劑的還原發生於pH = 10 ~ 10.5時,呈色效果最好(即所呈之色最深),不過,在此pH 下此試劑不安定,經過一段時間就會喪失其還原能力,則其反應力隨試劑中磷鉬酸根(phosphomolybdate)的原有黃色的消失而降低。
磷鉬酸根(phosphomolybdate)黃色的消失,係因此等陰離子(anion)發生解離所造成的。欲使本試劑有最大的呈色效果,宜使用pH 值近於10 的緩衝溶液,使其還原作用在此種緩衝溶液中進行。若蛋白質中兩個tyrosine residues 相距過近,則會降低其靈敏度,因此本法之靈敏度,受蛋白質分子中的tyrosine residues 數量及tyrosine residues 之排列間隔支配。又若蛋白質中不含aromatic amino acids,則不與本試劑起呈色反應,而不能使用本法定量。但一般說來,絕大部分的蛋白質都含有aromatic amino acids,故本法在酵素化學上最為常用。
IV. Bicinchoninc acid procedure (BCA)
BCA法與Lowry法相似,主要差別在鹼性溶液中,蛋白質使銅離子由二價轉變成一價後,進一步的以BCA 取代Folin reagent與一價銅離子結合產生很深的紫色,在波長562 nm有很強的吸光。本法的優點在於鹼性溶液中BCA 比Folin reagent穩定,因此BCA與鹼性銅離子溶液結合的呈色反應只需一步驟即完成。本法的靈敏度Lowry法相似(可測至約0.1-1.2 mg protein/ml),以微量分析(microassay) 靈敏度可測至約0.5-10 mg protein/ml。本方法對於陰離子、非離子性及二性離子的清潔劑(anionic, non-ionic, zwitterionic)、guanidine-HCl和尿素較具容忍度,較不受干擾,但也會受還原糖(reducing sugars) 及EDTA的干擾。
藥品配製:
1. Protein solutions were prepared in 0.15 M NaCl
2. 10 mM Na-citrate , pH 5緩衝液(10 mM citric acid及10 mM sodium citrate)
(1) 配1 M citric acid 500 ml: 取105.07 g citric acid (MW= 210.14),加入400 ml 二次水使其溶解後,將體積補至500 ml。
(2) 配1 M sodium citrate 500 ml: 取147.05 g sodium citrate (MW= 294.1) ,加入400 ml 二次水使其溶解後,將體積補至500 ml。
(3) 將1 M citric acid及1M sodium citrate分別稀釋為10 mM後,取1000 ml 10 mM sodium citrate於2 L錐型瓶中,再加入1000 ml 10 mM citrate acid 混合後,以pH meter 測定溶液酸鹼值,若低於pH 5 則加10 mM sodium citrate,若高於pH 5 則加10 mM citrate acid,直到pH值為5。
3. 100 mg/ml BSA: 取2 mg bovine albumin於錐形瓶中加入20 ml二次水,混合至完全溶解。
4. 蛋白質分析反應劑(Protein assay reagent) (0.01%(w/v) Coomassie Brilliant Blue G-250, 4.7% (w/v) ethanol, and 8.5%(w/v) phosphoric acid):
取0.1 g 之Coomassie Brilliant Blue G-250 (100mg;Sigma)溶於50 ml 95% 酒精中,完全溶解後加入100 ml之85%(w/v) phosphoric acid,最後將總體積以二次水補至一升。